24. (8分)工业上合成氨是在一定条件下进行如下反应:
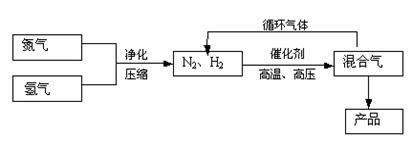 N2(g)+3H2(g)
N2(g)+3H2(g)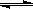 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
22. (8分)80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
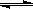 2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
N(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K= ; (3)要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
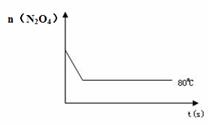 (4)如右图是80℃时容器中N2O4物质的量的变
(4)如右图是80℃时容器中N2O4物质的量的变
化曲线,请在该图中补画出该反应在60℃时N2O4
物质的量的变化曲线。 三、化学工业(2题,18分)
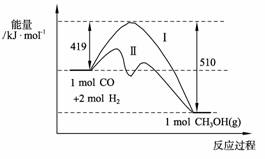 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。 用量及其他影响速率的条件确定之后,可以通过测定
用量及其他影响速率的条件确定之后,可以通过测定 
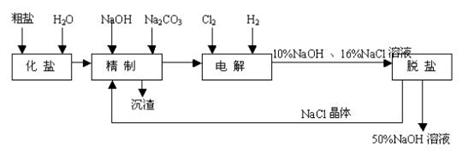 (10分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
(10分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
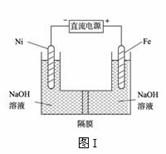
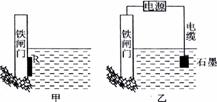 (3)右图中乙方案也可降低铁闸门腐
(3)右图中乙方案也可降低铁闸门腐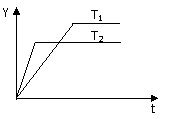 已知反应:N2(g)+3H2(g)
已知反应:N2(g)+3H2(g) 2NH3(g) △H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是
2NH3(g) △H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是 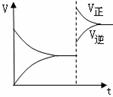 右图是反应A2(g)+3B2(g)
右图是反应A2(g)+3B2(g) CO2 +
H2
CO2 +
H2