20. (11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1) 第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2) 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
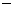 33.35 33.35 |
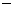 164 164 |
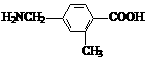
(3) 第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)
 碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为
。
碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为
。
18. A、B、C、D、E、F六种元素在周期表中的位置如图 所示,下列说法正确的是( )
所示,下列说法正确的是( )
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
|
|
|
D |
|
|
3 |
B |
|
|
|
E |
C |
F |
|
A.热稳定性:A2C>AD
B.EF3分子中所有原子均达到8电子稳定结构,且属于非极性分子
C.六种元素中的某些元素可以形成既含共价键又含 离子键的化合物
离子键的化合物
D.晶体熔点:BF<BD
第Ⅱ卷 非选择题(共78分)
14. 为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
|
|
被 提纯的物质 提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
乙酸乙酯(乙酸) |
CCl4 |
萃取、分液 |
|
B |
乙烷(乙烯) |
溴的苯溶液 |
洗气 |
|
C |
乙醇(乙酸) |
新制氧化钙 |
蒸馏 |
|
D |
苯(溴) |
NaOH溶液 |
分液 |
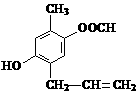
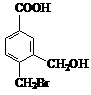
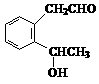
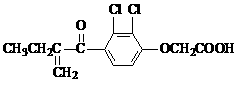
11. 下列实验操作、现象和结论对应关系正确的是( )w
|
编号 |
实验操作 |
实验现象 |
实验结论 |
|
A. |
将金属钠投入无水乙醇中 |
钠浮在液面上,剧烈反应,放出无色气体 |
Na可以置换出乙醇-OH中的H,产生H2 |
|
B. |
向溴的甲苯溶液中加入适量铁粉 |
剧烈反应,产生大量红棕色气体 |
溴与甲苯在铁的催化作用下发生了取代反应生成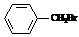 |
|
C. |
向淀粉与稀硫酸共热后的溶液中加入银氨溶液,水浴加热 |
产生光亮的银镜 |
淀粉水解可生成葡萄糖 |
|
D. |
向苯酚钠溶液中通入过量CO2 |
溶液变浑浊 |
酸性:碳酸>石炭酸 |
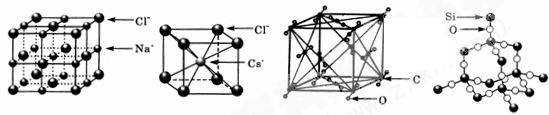 通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示:
通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示: