24.(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)
 2NH3(g) △H=
-92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H=
-92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
|
|
|
|
|
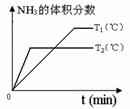
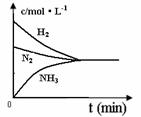

a. b. c.
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:
a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
22.(6分)已知25℃、101kpa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
|
△H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H= 。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
A.1∶1 B.1∶3 C.1∶4 D.2∶3
 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O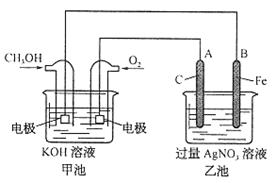
 (3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗
(3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗 _________L(标准状况下)。
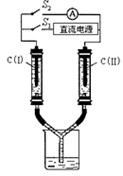
_________L(标准状况下)。 用铅蓄电池(总反应:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
用铅蓄电池(总反应:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。 Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是:
Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是:  C.溶液中钡离子数目减小
D.pH减小
C.溶液中钡离子数目减小
D.pH减小 A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)