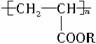27、(12分)为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A、冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B、用某仪器量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C、将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D、将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E、在锥形瓶下垫一张白纸,滴定至恰好反应为止,记下读数为V2mL。
F、把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G、用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
(1)正确操作步骤的顺序(用字母填写) → A → → → → → 。
(2)滴定中可选用的指示剂是 。滴定中,目光应注视 ;判断滴定恰好完成的依据是 ;
(3)某学生实验时用稀硫酸润洗了锥形瓶,测定的浓度会偏 。(填“大或小”)
(4)该浓硫酸样品纯度的计算式为 。
(5)若用0.1000 mol/L的NaOH溶液滴定20.00mL0.1000 mol/L的CH3COOH溶液,跟踪测试和记录的滴定过程中溶液PH的结果如下,ⅰ、请根据下表数据绘制PH随加入NaOH溶液的滴定曲线。(下图坐标中横坐标表示滴入CH3COOH溶液的体积,纵坐标表示PH值)
|
滴入HAc的体积 |
0.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
40.00 |
|
|
PH |
2.88 |
5.70 |
6.74 |
7.75 |
8.73 |
9.70 |
10.70 |
12.52 |
|
ⅱ、依据上表数据或滴定曲线可得出: ①CH3COOH是 (填“强”、“弱”或“非” )电解质。 ②在接近滴定终点(PH为7)时,一滴(约0.04mL)NaOH溶液就引起了溶液PH从 到 的突变。
26、(8分)结合以下表中信息,回答有关问题:
|
组号 |
反应温度 (℃) |
参加反应的物质 |
||||
|
Na2S2O3 |
H2SO4 |
H2O |
||||
|
V/ml |
c/mol·L- |
V/ml |
c/mol·L- |
V/ml |
||
|
A |
10 |
5 |
0.1 |
5 |
0.1 |
5 |
|
B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
|
C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
|
D |
30 |
5 |
0.2 |
5 |
0.2 |
10 |
(1)实验比较法是人们研究各类问题常用的方法,但在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。
上述表中可以比较的组合有 。
(2)上述反应的离子方程式为
(3)上述反应速率最快的是 ,最慢的是 。
(4)判断上述反应速率快慢的实验现象可以是 。