5.下物质分类组合正确的是
A B C D
强电解质: HBr FeCl3 H3PO4 Ca(OH)2
弱电解质: HF HCOOH BaSO4 HI
非电解质: CCl4 Cu H2O C2H5OH
24(15分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
 ① 用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
① 用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)用0.2000mol·L-1标准烧碱溶液滴定待测盐酸,选用酚酞为指示剂,滴定时两眼注视 ,直到滴入一滴标准NaOH溶液,溶液颜色变化是 , 且半分钟内不褪色时,则达到滴定终点。
(2)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”,下同)__________________
步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果_________________
若步骤⑤中读数时俯视,则测定结果将______________
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL
(4)改正错误后,根据下列数据:请计算待测盐酸溶液的浓度: mol/L
|
滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.40 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.00 |
|
第三次 |
20.00 |
2.00 |
24.10 |
25 (10分).在常温下,下列四种溶液:
① 0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4 ④ 0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈_________,其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
26 (8分). “碘钟”实验中,3I- +S2O82- ==I3- +2SO42- 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大,某探究学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
C(I-)/ mol/L |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
C(S2O82-)/ mol/L |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应速率影响符合一般规律,若在40℃下进行编号③对应浓度实验,显色时间t2的范围为 (填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
27.(15分)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+ Y(g) 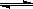 a Z(g) +
W(g) △H =-QkJ/mol (Q>0)
a Z(g) +
W(g) △H =-QkJ/mol (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1) 化学计量数a的值为 ,该反应的熵变△S 0(填“>”、“<”或“=”)
(2) 平衡常数K表达式=_______________温度升高平衡常数K的值将 _______________(填“增大”“减小”或“不变”
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确? ,其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2molX、1molY、1molAr B.a molZ、1mol W
C.1molX,0.5molY,0.5amolZ,0.5 mol W ;D.4 molX、2mol Y
(5) X的转化率α= (用含Q、Q1的代数式)
四计算题
28(6分).常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液与pH=3的某一元弱酸溶液20ml恰好完全反应,消耗了NaOH溶液13ml,试求:
(1)NaOH溶液的物质的量浓度。
(2)此一元弱酸的物质的量浓度。
(3)求此条件下该一元弱酸的电离平衡常数。
 台州中学2009-2010学年第二学期期中试题答题卷
台州中学2009-2010学年第二学期期中试题答题卷
高二 化学
 将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针
将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针 