6、甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)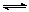 HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
|
反应时间范围/min |
0~5 |
10~15 |
20~25 |
30~35 |
40~45 |
50~55 |
75~80 |
|
平均反应速率/(10-3mol·min-1) |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,
甲酸甲酯的平均反应速率为 mol·min-1。
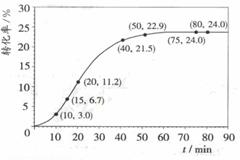 (2)依据以上数据,写出该反应的反应速率在不同
(2)依据以上数据,写出该反应的反应速率在不同
阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:
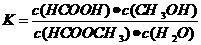 ,
,
则该反应在温度T1下的K值为 。
5、 在一定体积的密闭容器中,进行如下化学反应:A(g) +
3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:A(g) +
3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
|
t/K |
298 |
398 |
498 |
… |
|
K/(mol·L-1)-2 |
4.1×106 |
8.2×107 |
K1 |
… |
请完成下列问题:
该反应的化学平衡常数表达式为K= 。
判断该反应的ΔH 0(填“>”或“<”)
在一定条件下,不能判断该反应已达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.D的物质的量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
2、PCl5的热分解反应如下:PCl5(g)
 PCl3(g)+ Cl2(g)
PCl3(g)+ Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测
得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
 B.
B.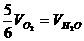
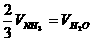 D.
D.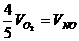
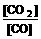 ,已知1100℃时,K=0.263 。
,已知1100℃时,K=0.263 。  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: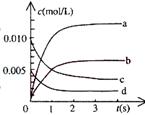 (1)写出该反应的平衡常数表达式:K=__
__。
(1)写出该反应的平衡常数表达式:K=__
__。 2SO2(g) + O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO2(g) + O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
 CH2(g) ==
CH4(g)+HC
CH2(g) ==
CH4(g)+HC HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)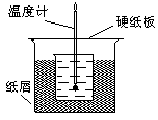 50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在右图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在右图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。