0 29729 29737 29743 29747 29753 29755 29759 29765 29767 29773 29779 29783 29785 29789 29795 29797 29803 29807 29809 29813 29815 29819 29821 29823 29824 29825 29827 29828 29829 29831 29833 29837 29839 29843 29845 29849 29855 29857 29863 29867 29869 29873 29879 29885 29887 29893 29897 29899 29905 29909 29915 29923 447348
 2SO3(g) △H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
2SO3(g) △H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是: 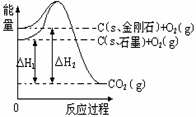 已知25℃、101kPa下,如右题图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol 。下列说法或表达正确的是:
已知25℃、101kPa下,如右题图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol 。下列说法或表达正确的是: H2(g)+Br2(g) 反应。下列四个图中可以表示该反应在一定条件下达到平衡状态的是:
H2(g)+Br2(g) 反应。下列四个图中可以表示该反应在一定条件下达到平衡状态的是: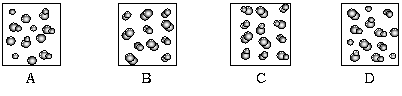
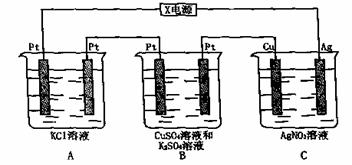
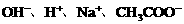 四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
四种离子,某同学推测其离子浓度大小顺序有如下四种关系: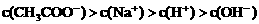
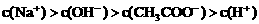
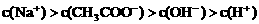
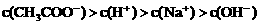
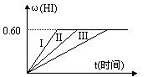
 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)