摘要:如图所示.若电解5min时铜电极增重2.16g.试回答: (1)电源电极X名称为 .C装置是 池, (2)pH变化为:A ,B ,C , (3)通电5min时.B中共收集224mL气体.溶液体积为200mL则通电前硫酸铜溶液的物质的量浓度是多少? (4)若A中KCl溶液的体积也是200mL.电解后.溶液的pH是多少? 天津市塘沽区09-10学年高二上学期期末质量检测
网址:http://m.1010jiajiao.com/timu3_id_298265[举报]
 17.
17.
(如东启东期中联考14分)如图所示,可视为质点的三物块A、B、C放在倾角为300、长L=2m的固定斜面上,物块与斜面间的动摩擦因数μ=![]() ,A与B紧靠在一起,C紧靠在固定挡板上,三物块的质量分别为mA=0.80kg、mB=0.64kg、mC=0.50kg,其中A不带电,B、C的带电量分别为qB=+4.0×10-5C、qC=+2.0×10-5C且保持不变,开始时三个物块均能保持静止且与斜面间均无摩擦力作用.如果选定两点电荷在相距无穷远处的电势能为0,则相距为r时,两点电荷具有的电势能可表示为
,A与B紧靠在一起,C紧靠在固定挡板上,三物块的质量分别为mA=0.80kg、mB=0.64kg、mC=0.50kg,其中A不带电,B、C的带电量分别为qB=+4.0×10-5C、qC=+2.0×10-5C且保持不变,开始时三个物块均能保持静止且与斜面间均无摩擦力作用.如果选定两点电荷在相距无穷远处的电势能为0,则相距为r时,两点电荷具有的电势能可表示为![]() .现给A施加一平行于斜面向上的力F,使A在斜面上作加速度a=1.5m/s2的匀加速直线运动,经过时间t0,力F变为恒力,当A运动到斜面顶端时撤去力F.已知静电力常量k=9.0×109N?m2/C2,g=10m/s2.求:
.现给A施加一平行于斜面向上的力F,使A在斜面上作加速度a=1.5m/s2的匀加速直线运动,经过时间t0,力F变为恒力,当A运动到斜面顶端时撤去力F.已知静电力常量k=9.0×109N?m2/C2,g=10m/s2.求:
(1)未施加力F时物块B、C间的距离;
(2)t0时间内A上滑的距离;
(3)t0时间内库仑力做的功;
(4)力F对A物块做的总功.
查看习题详情和答案>>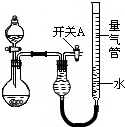 (2010?漳州二模)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
(2010?漳州二模)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)简述如何检查该装置的气密性:
关闭开关A和分液漏斗活塞,微热烧瓶,量气管左端液面升高,说明气密性良好
关闭开关A和分液漏斗活塞,微热烧瓶,量气管左端液面升高,说明气密性良好
.(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因.
不可行.因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准
不可行.因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准
.(3)实验②、③中,量气管中的液体最好分别是
B
B
、D
D
.(只选一种)A.H2OB.CCl4C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(4)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②
使量气管两端液面相平
使量气管两端液面相平
,③视线与凹液面最低处相平.(5)实验④获得以下数据(所有气体体积均已换算成标准状况)根据上述合理数据计算镁铝合金中铝的质量分数
27%
27%
.
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
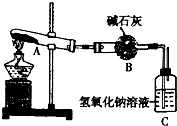 (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示. (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.
|
全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的
,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因.
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
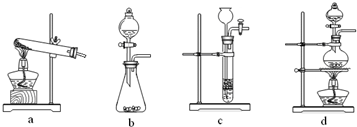
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
④在本实验中,下列情况会使测定结果n偏大的是
a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3?nH2O.
查看习题详情和答案>>
| 1 |
| 10 |
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
2Fe+O2+2H2O=2Fe(OH)2
2Fe+O2+2H2O=2Fe(OH)2
.
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
| 浓硫酸 |
| 加热 |
d
d
.(填字母)(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是
浓NaOH溶液
浓NaOH溶液
、浓硫酸
浓硫酸
.②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
通入混合气体一段时间
通入混合气体一段时间
.③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
2
2
.④在本实验中,下列情况会使测定结果n偏大的是
a
a
.(填字母)a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3?nH2O.
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(1)T的基态原子的价电子排布式为
(2)U、V两种元素可组成多种结构的分子.请写出符合下列条件的物质的结构简式:
若化合物V8U8中V元素均采取sp3杂化方式
若化合物V8U8中V元素均采取sp2杂化方式
(3)写出一种与V22-互为等电子体的分子的化学式为
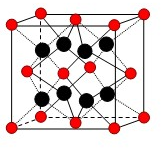
(4)甲和乙分别是W、X元素对应的氢化物,甲和乙中均属于10电子分子,甲极易溶于乙中,原因是
(5)ZY2晶体的晶胞如图所示,Z2+位于晶胞的顶点和面心,则Z2+的配位数为