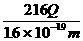24.(12分)某工业铁红中混有一种黑色的铁的氧化物杂质,为了解杂质的成分及测定
铁红的纯度,化学兴趣小组的同学进行了实验探究。请你参与过程分析与交流。
[查阅资料]
① 铁的常见氧化物:氧化亚铁(FeO)黑色固体,ω(Fe)=77.8%;
氧化铁(Fe2O3)红色固体,俗称铁红, ω(Fe)=70.0%;四氧化三铁(Fe3O4)黑色固体,俗称磁性氧化铁,ω(Fe)=72.4%。
② 装置A、B中分别盛装的是浓H2SO4和草酸(乙二酸H2C2O4)
 [实验准备]
[实验准备]
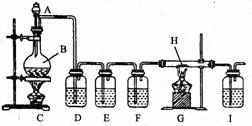
① 实验的装置图如右图:
② 药品及试剂:
a、草酸 b、工业铁红 c、NaOH溶液 d、澄清石灰水 e、浓H2SO4 f、盐酸[实验及数据]取不同质量的样品进行实验,所得实验数据如下:
|
实验序号 |
样品质量/g |
生成铁的质量/g |
|
1 |
4.00 |
2.91 |
|
2 |
8.00 |
7.00 |
|
3 |
10.00 |
7.27 |
|
4 |
12.00 |
8.72 |
|
5 |
14.00 |
10.18 |
|
6 |
16.00 |
11.63 |
[讨论与分析]
(1)写出装置B中发生反应的化学方程式 ;
(2)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、F应分别盛放的试剂为 、 (填序号),装置E的作用是 ;
(3)上述装置还有不完善之处,你建议的改进措施是 ;
(4)由实验数据不难得出,有-组实验数据不可靠,计算时要舍去,该组数据是_______ (填序号),该工业粗铁红所含杂质的化学式为 ;
(5)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中还含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,一定不含有Fe2O3。你认为该方案合理吗? ,理由是 。
20.通常人们把拆开1mol化学键所吸收的能量看成键能,键能的大小可以衡量化学键的
强弱,也可以用于计算化学反应中的反应热(△H),化学反应中的△H等于反应中断裂的
化学键的键能之和与反应中形成新的化学键的键能之和的差
|
化学键 |
Si-Cl |
H-H |
H-Cl |
Si-Si |
|
键能/KJ.mol |
360 |
436 |
431 |
176 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)==Si(s)+4HCl(g),该反应的△H为:
A、 412KJ/mol B、 -412KJ/mol C、 236KJ/mol D、 -236KJ/mol
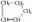 ① 是环戊烯的结构简式,可进一步简写为
① 是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似.
,环烯烃的化学性质跟烯烃相似. 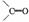 ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如: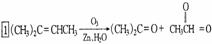
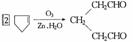
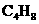 的不饱和烃的混合气体,经臭氧分解后生成8.7 g酮、0.45mol的醛(其中甲醛有0.21 mol).则氧化后生成物的结构简式为______________.
的不饱和烃的混合气体,经臭氧分解后生成8.7 g酮、0.45mol的醛(其中甲醛有0.21 mol).则氧化后生成物的结构简式为______________.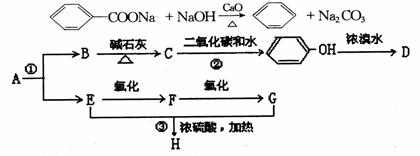
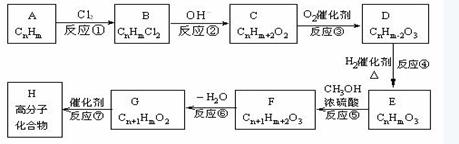
 C D,
C D,  F G
F G 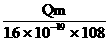 B、
B、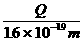
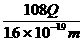 D、
D、