16. (9分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(9分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:

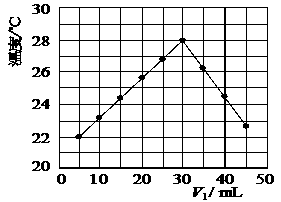
 (1)研究小组做该实验时环境温度
(填“高于”、“低于”或“等于”)22 ℃,判断的依据是
(1)研究小组做该实验时环境温度
(填“高于”、“低于”或“等于”)22 ℃,判断的依据是
 。
。
 (2)由题干及图形可知,V1/V2= : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为
mol/L。
(2)由题干及图形可知,V1/V2= : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为
mol/L。
 (3)若通过实验测定及有关计算知当HCl溶液与NaOH溶液完全反应时共放出Q kJ的热量,请写出此反应的热化学方程式:
(3)若通过实验测定及有关计算知当HCl溶液与NaOH溶液完全反应时共放出Q kJ的热量,请写出此反应的热化学方程式:
 (4).常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)下表是一些键能数据(kJ·mol-1)
(4).常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)下表是一些键能数据(kJ·mol-1)
|
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
|
H-H |
436 |
H-N |
391 |
H-F |
565 |
F-F |
158 |
根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = -46 kJ·mol-1

 计算N≡N的键能=
。
计算N≡N的键能=
。

12. 一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是
一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是
 A.反应达平衡时N2的转化率为7.5%
A.反应达平衡时N2的转化率为7.5%
 B.反应进行到10s末时,H2的平均反应速率是0.0225mol(L·s)-1
B.反应进行到10s末时,H2的平均反应速率是0.0225mol(L·s)-1
 C.该反应达到平衡时的标志可以是容器中气体密度不再改变
C.该反应达到平衡时的标志可以是容器中气体密度不再改变
 D.该反应达到平衡时的标志可以是容器中气体压强不再改变
D.该反应达到平衡时的标志可以是容器中气体压强不再改变

|
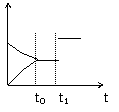 13.如图是表示:2X(g)+Y(S)
13.如图是表示:2X(g)+Y(S)  Z(g)+R(g) △H>0的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
Z(g)+R(g) △H>0的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
 A.减少Z物质
B.加大压强
A.减少Z物质
B.加大压强
 C.升高温度
D.使用催化剂
C.升高温度
D.使用催化剂
 一定温度下,有可逆反应:2A(g)+2B(g)
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);△H<0。现将2mol A和2mol B充入体积为V的甲容器,将2mol C和6mol D充入乙容器,调节砝码使乙容器在反应开始前的体积为2V(如右图)。关于两容器中反应的说法正确的是
C(g)+3D(g);△H<0。现将2mol A和2mol B充入体积为V的甲容器,将2mol C和6mol D充入乙容器,调节砝码使乙容器在反应开始前的体积为2V(如右图)。关于两容器中反应的说法正确的是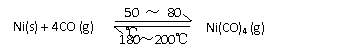 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是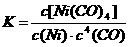
 2SO3(g);△H=-Q kJ/mol(Q>0),则下列说法正确的是
2SO3(g);△H=-Q kJ/mol(Q>0),则下列说法正确的是 CO2(g)+H2(g) 其化学平衡常数K和温度T有如下关系,则下列有关的叙述不正确的是( )
CO2(g)+H2(g) 其化学平衡常数K和温度T有如下关系,则下列有关的叙述不正确的是( ) T/℃ 700 800 830 1000 1200
T/℃ 700 800 830 1000 1200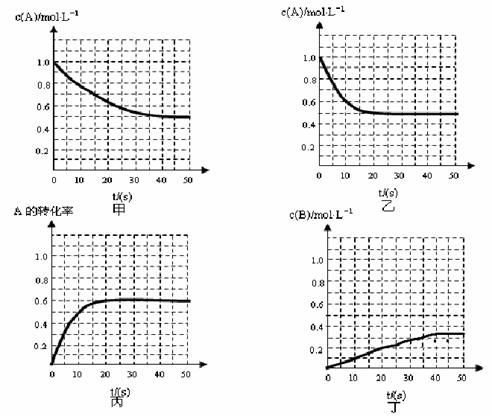

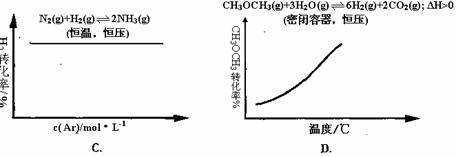
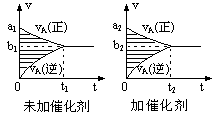 可逆反应mA(g)+nB(g)
可逆反应mA(g)+nB(g)