3. (08年广东理基·27)根据表1信息,判断以下叙述正确的是C
表1 部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
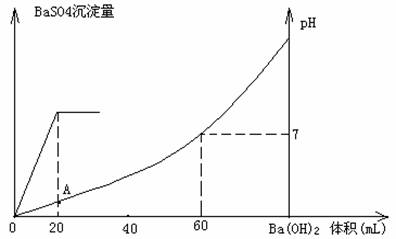
19.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,
若a 7(填>、<或=),则HA为强酸;
若a 7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度(A-)与(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
。
(4)丁组实验所得混合溶液中由水电离出的c(H+)= mol·L-1。
17.(15分)若用浓度为0.2mol·L-1的标准盐酸滴定一未知浓度的氢氧化钠溶液(一、二两次滴定),再用此氢氧化钠溶液滴定另一未知浓度的盐酸(三、四两次滴定),滴定时纪录了以下4组数据:
|
滴定次数 |
待测碱(酸)溶液体积V/mL |
标准酸(碱)溶液 |
||
|
滴定前刻度 |
滴定后刻度 |
消耗体积/mL |
||
|
第一次 |
10.0(NaOH) |
0 |
10.42 |
|
|
第二次 |
10.0(NaOH) |
12.20 |
22.78 |
|
|
第三次 |
10.0(HCl) |
0 |
11.42 |
|
|
第四次 |
10.0(HCl) |
11.10 |
22.54 |
|
(1)由以上数据可算出待测碱液浓度为 mol·L-1,待测酸液浓度为 mol·L-((2)在三、四两次滴定中,应选用 作指示剂,达滴定终点的现象是
.
(3)若在滴定实验过程中存在下列操作,其中会使待测液的浓度偏小的是 .
A.锥形瓶水洗之后未用待测液润洗
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.装标准液的滴定管未用标准液润洗
D.滴定前仰视读数,滴定后俯视读数
 Pt的说法正确的是A
Pt的说法正确的是A Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素