30. (6分)温度T℃时,某Ba(OH)2稀溶液中c(H+)=10-amol· L-1、c(OH-)=10-bmol·L-1,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW= ;
(2)b= ,原Ba(OH)2稀溶液的物质的量浓度为 ;
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大值,若原硫酸与硫酸钠混合溶液的pH为4,则其中硫酸钠的物质的量浓度为 。
27.
(10分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=QkJ·mol-1,其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g) ΔH=QkJ·mol-1,其化学平衡常数K和温度t的关系如下:
|
t/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”);
(2)能判断该反应已达到化学平衡状态的依据是 ;
a.容器中压强不变 b.ΔH不变
c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的物质的量浓度(mol·L-1)变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的物质的量浓度(mol·L-1)变化如下表:
850℃时,各物质的物质的量浓度(mol·L-1)的变化
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3min时c(CO))= mol·L-1 ,H2O(g)的转化率= ;
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气
24.
|
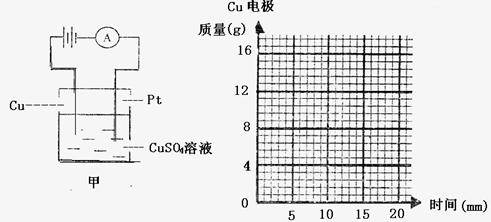 (6分 )如图甲所示将质量为8g的铜片和铂片插入200mlCuSO4溶液中,以电流强度为I的电流通电5min,然后反接电源继续通电10min,此时CuSO4恰好被完全电解,铂电极产生的气体为1.12L(标准状况下测定)。
(1)请依次写出5-15min内铂电极上的电极反应式:
; 。
(2)若要使电解后所得溶液恢复至与原溶液完全一样,可加入物质
(填化学式)其质量为
g。
(3)在图乙中画出铜电极质量随时间变化的关系曲线。
(6分 )如图甲所示将质量为8g的铜片和铂片插入200mlCuSO4溶液中,以电流强度为I的电流通电5min,然后反接电源继续通电10min,此时CuSO4恰好被完全电解,铂电极产生的气体为1.12L(标准状况下测定)。
(1)请依次写出5-15min内铂电极上的电极反应式:
; 。
(2)若要使电解后所得溶液恢复至与原溶液完全一样,可加入物质
(填化学式)其质量为
g。
(3)在图乙中画出铜电极质量随时间变化的关系曲线。
(3)Cu电极
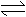 X(s)+3Y(g) Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为
X(s)+3Y(g) Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为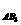 =0.6mol·L-1min-1
D、v
=0.6mol·L-1min-1
D、v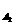 =0.01mol·L-1·S-1
=0.01mol·L-1·S-1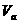 、pH=α的某一元强酸溶液与体积为
、pH=α的某一元强酸溶液与体积为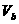 、pH=b的某一元强碱溶液混合后恰好完全反应。若
、pH=b的某一元强碱溶液混合后恰好完全反应。若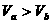 ,且α=0.4b,请填写下列空白:
(1)a可否等于2?(填“可”或“否”)______________理由是______________________。
(2)a可否等于4?(填“可”或“否”)_____________理由是_______________________。
(3)a的取值范围是____________________________________。
,且α=0.4b,请填写下列空白:
(1)a可否等于2?(填“可”或“否”)______________理由是______________________。
(2)a可否等于4?(填“可”或“否”)_____________理由是_______________________。
(3)a的取值范围是____________________________________。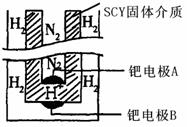 (12分)合成氨工业对化学工业和国防工业具有重要意义,对我国实现农业现代化起着重要作用。已知:25 0C
时,N2(g)+3H2(g)
(12分)合成氨工业对化学工业和国防工业具有重要意义,对我国实现农业现代化起着重要作用。已知:25 0C
时,N2(g)+3H2(g)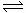 2NH3(g);△H=-92.4kJ/mol。
(1)25 0C时,在容积固定为2 L的密闭容器内充入1 mol N2和2 mol H2,经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为 。
(2)25 0C时,密闭容器中1 mol N2 和3 mol H2在催化剂存在下进行反应,测得反应放出的热量为9.24 kJ,则密闭容器中H2 的转化率为 。
(3)25 0C时,在容积固定为2 L的密闭容器内,开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是 (分别用含a、b、c的方程式表示)。
2NH3(g);△H=-92.4kJ/mol。
(1)25 0C时,在容积固定为2 L的密闭容器内充入1 mol N2和2 mol H2,经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为 。
(2)25 0C时,密闭容器中1 mol N2 和3 mol H2在催化剂存在下进行反应,测得反应放出的热量为9.24 kJ,则密闭容器中H2 的转化率为 。
(3)25 0C时,在容积固定为2 L的密闭容器内,开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是 (分别用含a、b、c的方程式表示)。
 (4)相同温度下,有恒容密闭容器A、恒压密闭容器B, 两容器中均充入1molN2和3molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a ,放出热量Q1kJ;B中NH3的体积分数为b ,放出热量Q2kJ。则:
a_____b(填“>”、“=”或“<”,下同),Q1_____
Q2,Q1_____92.4。
(5)一定条件下NH3的平衡体积分数随n(N2)变化如右图所示 (T为温度),则T2_____T1(填“>”、“=”或“<”)。
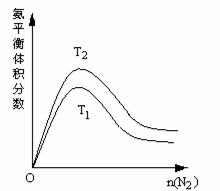
(6)随着合成氨研究的发展,希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),吸附在SCY内外表面上的金属钯多晶薄膜作为两个电极实现了常压、570℃条件下高转化率的电化学合成氨。其实验装置如右图。在该装置中钯电极A的电极反应方程式为
。
(4)相同温度下,有恒容密闭容器A、恒压密闭容器B, 两容器中均充入1molN2和3molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a ,放出热量Q1kJ;B中NH3的体积分数为b ,放出热量Q2kJ。则:
a_____b(填“>”、“=”或“<”,下同),Q1_____
Q2,Q1_____92.4。
(5)一定条件下NH3的平衡体积分数随n(N2)变化如右图所示 (T为温度),则T2_____T1(填“>”、“=”或“<”)。
(6)随着合成氨研究的发展,希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),吸附在SCY内外表面上的金属钯多晶薄膜作为两个电极实现了常压、570℃条件下高转化率的电化学合成氨。其实验装置如右图。在该装置中钯电极A的电极反应方程式为
。 (10分)已知NO2和N2O4可以相互转化:2NO2(g)
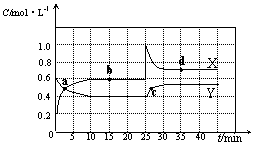
(10分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10min内用NO2表示的化学反应速率v(NO2)=
mol·L-1·min-1。
②反应2NO2(g)
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10min内用NO2表示的化学反应速率v(NO2)=
mol·L-1·min-1。
②反应2NO2(g)
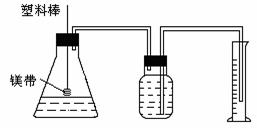 (12分)某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同,在下图装置的锥形瓶中分别装入1mol•L-1的盐酸和醋酸各10mL,进行实验。
(1)分别称取除去表面氧化膜的镁带ag,并系于塑料棒的末端。则a的数值至少为
g。
(2)除了上图装置中出现的实验仪器和用品外,本实验还需用到的仪器和用品有:天平、100mL量筒、剪刀、胶头滴管、
和 。
(3)在广口瓶中装足量水,按图连好装置后,要 (填操作名称)。
(4)将塑料棒向下移动,使镁条全部浸入酸中,至酸反应完成。为了比较反应速率和产生氢气的体积,应记录的实验数据为
和
。
(5)实验结果表明:镁带和盐酸的反应速率比镁带和醋酸的反应速率 (填“快”或“慢”),理由是
。
(6)下列情况中可能导致反应速率变快的是 (填序号,下同);可能导致产生氢气的体积减少的是
。
A.镁带中含有少量跟酸不反应的杂质 B.没有除去镁带表面的氧化膜
C.镁带中含有少量的杂质铁
(12分)某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同,在下图装置的锥形瓶中分别装入1mol•L-1的盐酸和醋酸各10mL,进行实验。
(1)分别称取除去表面氧化膜的镁带ag,并系于塑料棒的末端。则a的数值至少为
g。
(2)除了上图装置中出现的实验仪器和用品外,本实验还需用到的仪器和用品有:天平、100mL量筒、剪刀、胶头滴管、
和 。
(3)在广口瓶中装足量水,按图连好装置后,要 (填操作名称)。
(4)将塑料棒向下移动,使镁条全部浸入酸中,至酸反应完成。为了比较反应速率和产生氢气的体积,应记录的实验数据为
和
。
(5)实验结果表明:镁带和盐酸的反应速率比镁带和醋酸的反应速率 (填“快”或“慢”),理由是
。
(6)下列情况中可能导致反应速率变快的是 (填序号,下同);可能导致产生氢气的体积减少的是
。
A.镁带中含有少量跟酸不反应的杂质 B.没有除去镁带表面的氧化膜
C.镁带中含有少量的杂质铁 (10分)图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性质--只允许阳离子通过,而阻止阴离子和气体通过。
(10分)图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性质--只允许阳离子通过,而阻止阴离子和气体通过。