15.(12分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于酸。通常用饱和Na2CO3溶液处理BaSO4,待达到平衡后移走上层溶液;再加入饱和Na2CO3溶液,重复处理多次,使绝大部分BaSO4转化为BaCO3。
⑴请用简要的文字和方程式分析上述转化的原理
。
⑵某实验小组的同学测定沉淀样品中所含碳酸钡的质量分数,有如下操作:
Ⅰ.准确称取0.250g所得的样品,磨碎后加入少量蒸馏水;
Ⅱ.加入35.00mL0.1mol·L-1 的盐酸,使其充分反应;
Ⅲ.以酚酞为指示剂,用0.1mol·L-1 NaOH溶液滴定滴定至终点;
Ⅳ.重复上述操作2次。
①第Ⅰ步准确称取0.250g样品所使用的仪器是 ;第Ⅱ步操作中加入35.00mL0.1mol·L-1 的盐酸所使用的仪器是 。
②判断滴定达到终点的现象为 。
③下表是该实验的记录结果:
|
滴定 次数 |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
|
|
1 |
1.02 |
16.05 |
|
2 |
2.00 |
16.99 |
|
3 |
0.11 |
15.09 |
通过计算,沉淀样品中BaCO3的质量分数为 。
④下列操作使所测碳酸钡的质量分数偏大的是 。
A.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
B.向样品中加盐酸时,有少量盐酸溅出
C.滴定到终点时,滴定管尖嘴悬有液滴
D.读滴定管开始时仰视,终点读数时俯视
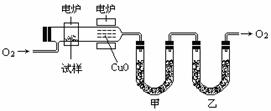 步骤一:这种碳氢化合物蒸汽通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸汽氧化产生7.04g二氧化碳和1.8g水。
步骤一:这种碳氢化合物蒸汽通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸汽氧化产生7.04g二氧化碳和1.8g水。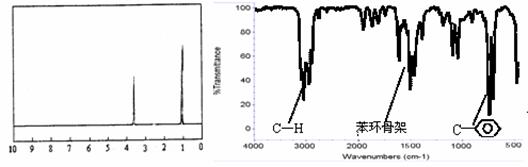
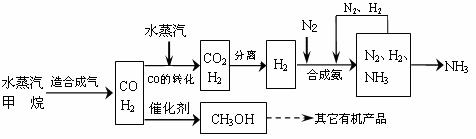
 CH3OH(g)。该反应发生时,催化剂Cu2O与一氧化碳发生了反应,且该反应为可逆反应,写出Cu2O与一氧化碳发生反应的化学方程式
;实验表明,反应体系中含一定量CO2有利于维持反应过程中催化剂Cu2O的物质的量不变,原因是
。
CH3OH(g)。该反应发生时,催化剂Cu2O与一氧化碳发生了反应,且该反应为可逆反应,写出Cu2O与一氧化碳发生反应的化学方程式
;实验表明,反应体系中含一定量CO2有利于维持反应过程中催化剂Cu2O的物质的量不变,原因是
。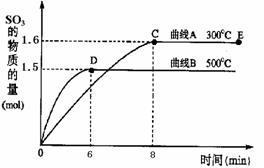 已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2
已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2 2SO3。
2SO3。
 A.该有机物的分子式为C3H6O6
A.该有机物的分子式为C3H6O6