16.(21分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:
分别取A、B的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
|
实验方法 |
实验现象 |
结 论 |
|
分别向A、B溶液中加 KSCN溶液 |
|
固体物质中有FeCl3 |
|
分别向KMnO4溶液中 加适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含
|
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:
。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是
。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)实际应用:
① 半导体、多媒体行业要用FeCl3溶液做印刷电路铜板腐蚀剂,请写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
② 腐蚀铜板后的混合溶液中,若Cu2+和Fe3+的浓度均为0.1mol/L,则溶液中Fe2+的浓度为 mol/L,原FeCl3溶液中Fe3+的浓度为 mol/L。
③ 请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤: 。
|
|
氢氧化物 开始沉淀时的pH |
氢氧化物 沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu |
④ 某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、 。
劣质不锈钢腐蚀的实验现象 。
 C.
C2H5OH D.
C.
C2H5OH D.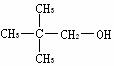
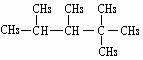 ,则该烯烃的结构式可能有几种
,则该烯烃的结构式可能有几种 CH4↑ + Na2CO3
CH4↑ + Na2CO3 CH3CH2OCH2CH3
+ H2O
CH3CH2OCH2CH3
+ H2O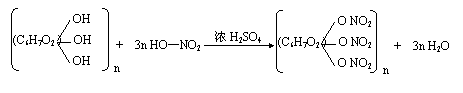 C.
C. CH3COONH4
+ Ag↓ + 3NH3
+ H2O
CH3COONH4
+ Ag↓ + 3NH3
+ H2O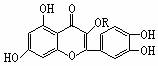 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是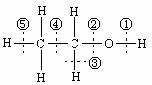 乙醇分子结构中各种化学键如右图所示,关于乙醇在各种反应中断裂键的说明不正确的是
乙醇分子结构中各种化学键如右图所示,关于乙醇在各种反应中断裂键的说明不正确的是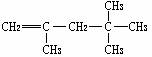 ,其名称正确的是
,其名称正确的是