22.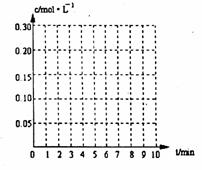 在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a
mol·L-1。
在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a
mol·L-1。
(1)0min-4min内生成O2平均速率v(O2)=
mol·L-1·min-1;
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min-8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
20、把温度为13℃,浓度为1.0 mol·L-1的酸溶液和1.1mol·L-1的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动。测得酸碱混合液的温度变化数据如下:
|
反应物 |
起始温度t1/℃ |
终了温度t2/℃ |
中和热 |
|
HCl+NaOH |
13 |
19.8 |
△H1 |
|
HCl+NH3·H2O |
13 |
19.3 |
△H2 |
(1)试计算上述两组实验测出的中和热:△H1=________;△H2=________。
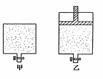 (2)实验中碱液过量的目的是________________________________。
(2)实验中碱液过量的目的是________________________________。
(3)两组实验结果差异的原因是________________________________。
 3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2 mol/L的是
3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2 mol/L的是