1.下列试剂的保存方法,错误的是:
A.把浓硝酸放在棕色瓶中,并置于冷暗处保存
B.把AgNO3放在棕色瓶中保存
C.把红磷放在广口瓶中密闭保存,把白磷保存在煤油中保存
D.把NaOH溶液放在带橡皮塞的玻璃瓶中保存
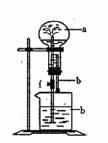 2.在下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:
2.在下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:
|
|
a(干燥气体) |
B(液体) |
|
A |
NO2 |
水 |
|
B |
CO2 |
饱和NaHCO3溶液 |
|
C |
Cl2 |
饱和NaCl溶液 |
|
D |
NH3 |
1mol·L-1盐酸 |
 18.(9分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
18.(9分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴
酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使
之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”至“0”刻度以下,记下读数
|
回答下列问题:
(1)正确的操作顺序是:B、 、F(填序号)
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
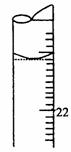
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL.
 19.(7分)下图为氨氧化法制硝酸的实验装置示意图
19.(7分)下图为氨氧化法制硝酸的实验装置示意图
A.氨水(浓氨水:水= 1.5:1) B.催化剂(Cr2O3)
C.干燥剂(无水氯化钙) D.氧化瓶
E.吸收瓶(水、石蕊溶液) F.NaOH溶液
请回答下列问题:
(1)装置B中发生反应的化学方程式为 ;
(2)该实验的装置B中使用Cr2O3作催化剂,而工业生产中实际使用的催化剂主要是
;
(3)装置E中反应时,氧化剂与还原剂的质量比为 ;
(4)F中用NaOH溶液吸收氮的氧化物,NO2被NaOH溶液吸收生成硝酸盐和亚硝酸盐的水溶液,其离子方程式为 。
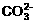 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
 (8分)现有反应:CO(g) + H2O(g) CO2(g)
+ H2(g) △H < 0,在850℃时,平衡常数K = 1。
(8分)现有反应:CO(g) + H2O(g) CO2(g)
+ H2(g) △H < 0,在850℃时,平衡常数K = 1。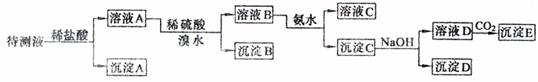 22.(8分)某待测液中,可能含有Fe2+、Fe3+、Ag+、Al3+、Ca2+、NH4+、Ba2+等离子。进行下述实验(所加试剂均是过量的)。
22.(8分)某待测液中,可能含有Fe2+、Fe3+、Ag+、Al3+、Ca2+、NH4+、Ba2+等离子。进行下述实验(所加试剂均是过量的)。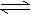 可逆反应:A (g) + 2B(g) 3C(g) + D(s)(正反应的
可逆反应:A (g) + 2B(g) 3C(g) + D(s)(正反应的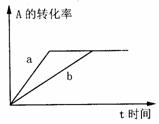 C.氢氧化钠过量 D.醋酸有剩余
C.氢氧化钠过量 D.醋酸有剩余