25、(12分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
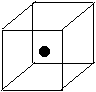
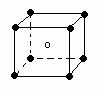
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
23、(16分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
 试回答下列问题:
试回答下列问题:
(1)请写出元素O的基态原子电子排布式
。
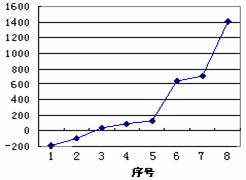
(2)第三周期8种元素按单质熔点高低
的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是
(填右图中的序号)。
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相
比熔点更高的是 (填化学式),试从结构角度加以解释:
。
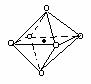
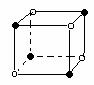
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
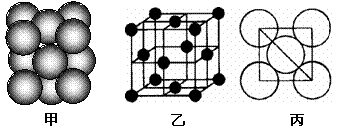
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为___ ___ _ ,一个晶胞中i原子的数目为_ _;
②该晶体的密度为______ _ (用字母表示)。
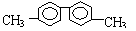
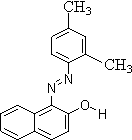 .已知C-C单键可以绕键轴旋转,其结构简式可表示为
的烃,下列说法中正确的是( )
.已知C-C单键可以绕键轴旋转,其结构简式可表示为
的烃,下列说法中正确的是( )
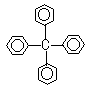 甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子被苯基取代,则可得到的分子如图所示,对该分子的描述中,不正确的是:
( )
甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子被苯基取代,则可得到的分子如图所示,对该分子的描述中,不正确的是:
( )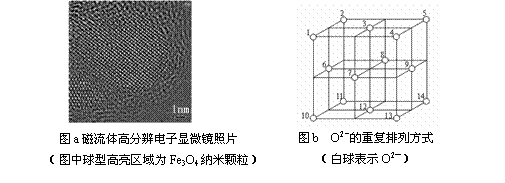

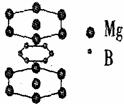 (1)试写出这种超导材料的化学式
;
(1)试写出这种超导材料的化学式
;