0 23170 23178 23184 23188 23194 23196 23200 23206 23208 23214 23220 23224 23226 23230 23236 23238 23244 23248 23250 23254 23256 23260 23262 23264 23265 23266 23268 23269 23270 23272 23274 23278 23280 23284 23286 23290 23296 23298 23304 23308 23310 23314 23320 23326 23328 23334 23338 23340 23346 23350 23356 23364 447348
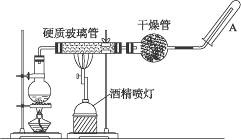
 Fe3O4+4H2↑
Fe H2O
Fe3O4+4H2↑
Fe H2O