29.
|
|
|
|
|
|
|
|

 石灰石 生石灰 熟石灰溶液
石灰石 生石灰 熟石灰溶液


|

 熔融MgCl2
Mg
熔融MgCl2
Mg
⑴从海水中提取食盐,是利用 和风力使水分蒸发,得到食盐。
⑵反应①的化学方程式是
⑶操作甲的名称是
⑷小李观察到老师每次拿镁条来做实验时,镁条表面总是有一层灰黑色的“外衣“,用砂布擦去才露出银白色的金属光泽。他请教老师后知道,这层“外衣”是镁条与空气中某些物质化合生成的一种化合物。他猜想,可能是MgO,也可能是Mg(OH)2 ,老师引导他分析,
该“外衣”不可能是MgO,原因是
⑸小李收集了一些干燥的该“外衣”,放入一个与空气、其他物质相隔绝的容器中加热,并将生成的气体依次通入装有干燥剂(只吸收水分,不产生新的气体)的干燥管和装有足量澄清石灰水的烧杯中。结果,干燥管质量增加,澄清石灰水变白色浑浊。
①该“外衣”不可能是Mg(OH)2, 原因是(不能只答实验现象)
②组成该“外衣”的所有元素的元素名符号是
③与镁反应生成该”外衣”的所有物质是
⑹假设镁条表面的“外衣”都是碱式碳酸镁(与碱式碳酸铜相似),现取该镁条6.22g,放入94.62g稀盐酸中,固体恰好完全溶解,产生0.44gCO2,求所得溶液的溶质质量分数。
2009-2010学年仪征金升外国语实验学校中考模拟

 元素周期表是学习化学的重要工具。右图是元素周期表中的一格,从中获取的信息错误的是
元素周期表是学习化学的重要工具。右图是元素周期表中的一格,从中获取的信息错误的是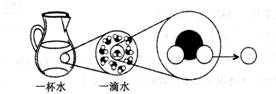
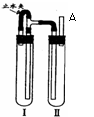 ⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。
⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。