摘要:29. 加盐酸 反应① 加水 煅烧 北海市滨临的北部湾是一个巨大的资源库.例如.可以从海水中提取食盐.也可以从海水中提取用途广泛的金属镁.其制取工艺流程如下: 海水中的MgCl2 Mg(OH)2沉淀 蒸发.结晶.加热 操作甲 石灰石 生石灰 熟石灰溶液 通电 熔融MgCl2 Mg ⑴从海水中提取食盐.是利用 和风力使水分蒸发.得到食盐. ⑵反应①的化学方程式是 ⑶操作甲的名称是 ⑷小李观察到老师每次拿镁条来做实验时.镁条表面总是有一层灰黑色的“外衣“.用砂布擦去才露出银白色的金属光泽.他请教老师后知道.这层“外衣 是镁条与空气中某些物质化合生成的一种化合物.他猜想.可能是MgO.也可能是Mg(OH)2 .老师引导他分析. 该“外衣 不可能是MgO.原因是 ⑸小李收集了一些干燥的该“外衣 .放入一个与空气.其他物质相隔绝的容器中加热.并将生成的气体依次通入装有干燥剂(只吸收水分.不产生新的气体)的干燥管和装有足量澄清石灰水的烧杯中.结果.干燥管质量增加.澄清石灰水变白色浑浊. ①该“外衣 不可能是Mg(OH)2, 原因是 ②组成该“外衣 的所有元素的元素名符号是 ③与镁反应生成该 外衣 的所有物质是 ⑹假设镁条表面的“外衣 都是碱式碳酸镁.现取该镁条6.22g.放入94.62g稀盐酸中.固体恰好完全溶解.产生0.44gCO2.求所得溶液的溶质质量分数. 2009-2010学年仪征金升外国语实验学校中考模拟
网址:http://m.1010jiajiao.com/timu3_id_19772[举报]
为测定标有质量分数为32%的盐酸的实际质量分数,小明实验时先在烧杯中加入20g40%的氢氧化钠溶液,再逐滴加入该盐酸,测定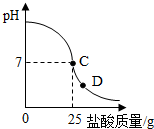 出加入盐酸的质量与烧杯中溶液pH的关系如图.
出加入盐酸的质量与烧杯中溶液pH的关系如图.
(1)所用氢氧化钠溶液中溶质的质量为
(2)请认真看清右图信息后回答以下问题
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?
②该盐酸的实际质量分数是多少?(保留到0.1%)
③导致盐酸溶液溶质质量分数改变的原因是:
④当滴加盐酸到图象中D点时,烧杯中溶液的溶质是
查看习题详情和答案>>
 出加入盐酸的质量与烧杯中溶液pH的关系如图.
出加入盐酸的质量与烧杯中溶液pH的关系如图.(1)所用氢氧化钠溶液中溶质的质量为
8
8
g.(2)请认真看清右图信息后回答以下问题
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?
②该盐酸的实际质量分数是多少?(保留到0.1%)
③导致盐酸溶液溶质质量分数改变的原因是:
盐酸有挥发性
盐酸有挥发性
.④当滴加盐酸到图象中D点时,烧杯中溶液的溶质是
HCl、NaCl
HCl、NaCl
.(填化学式)29、小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度.于是他对所得溶液的酸碱性进行探究.
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈
【实验验证】

【分析与思考】
1溶液呈碱性,则溶液中使其呈碱性的离子是
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到
方案二:取样,加入
查看习题详情和答案>>
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈
中
性,还可能呈酸
性.【实验验证】

【分析与思考】
1溶液呈碱性,则溶液中使其呈碱性的离子是
OH-
(填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入CuCl2
溶液,直到不再产生沉淀为止.然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为CuCl2+2NaOH═Cu(OH)2↓+2NaCl
.(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到
有气泡产生
,则所取溶液呈酸性;若无明显现象,则呈中性.方案二:取样,加入
锌粒
,若观察到Zn+2HCl═ZnCl2+H2↑
,则所取溶液呈酸性,该若无明显现象,则呈中性.