摘要:02×1023mol-只是阿伏加德罗常数的近似值.其真实值为 .由此看来. 就是定义“1mol 的标准. [质疑激趣]: 1mol 含有6.02×1023个.2mol 含有2×6.02×1023个.则物质的量(n).阿伏加德罗常数(NA)与物质所含的微粒数(N)之间的关系怎样?
网址:http://m.1010jiajiao.com/timu3_id_195382[举报]
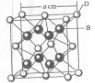
有A、B、C、D、E、F六种元素.A是宇宙中最丰富的元素;B是周期表中电负性数值最大的元素;C的基态原子中2p轨道有三个未成对的单电子;F原子核外电子数是B与C核外电子数之和;D是主族元素,且与副族元素E同周期;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化物;D与B可形成离子化合物,其晶胞结构如右图1所示.请回答下列问题.
(1)E元素原子基态时的外围电子排布式为
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因是
(4)从晶胞结构图1中可以看出,D跟B形成的离子化合物的电子式为
 ;该离子化合物晶体的密度为ρ(g?cm-3).,则晶胞的体积是
;该离子化合物晶体的密度为ρ(g?cm-3).,则晶胞的体积是
(只要求列出算式).
(5)BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为
(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为

查看习题详情和答案>>
(1)E元素原子基态时的外围电子排布式为
3d104s1
3d104s1
.(2)A2F分子中F原子的杂化类型是
sp3
sp3
,F的气态氧化物FO3分子的键角为60°
60°
.(3)CA3极易溶于水,其原因是
与水分子之间形成氢键,且二者都是极性分子
与水分子之间形成氢键,且二者都是极性分子
,试判断CA3溶于水后,形成CA3?H2O的最合理结构为b
b
(选填字母).(4)从晶胞结构图1中可以看出,D跟B形成的离子化合物的电子式为


| ||
| ρg?cm-3 |
| ||
| ρg?cm-3 |
(5)BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为
正四面体
正四面体
;(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
共价键
共价键
,层间作用力为范德华力
范德华力
.
 (2011?开封一模)[化学--选修物质结构与性质]
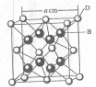
(2011?开封一模)[化学--选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如图.请回答:
(1)A与c形成的共价化合物的分子式是
SiH4
SiH4
,杂化轨道是sp3
sp3
,分子的立体结构是正四面体
正四面体
.(2)B与C比较,电负性较小的是
Si
Si
(填元素符号);B与c形成的化合物晶体类型是分子晶体
分子晶体
. (3)E属元素周期表中第
四
四
周期,第ⅡB
ⅡB
族的元素,其元素名称是锌
锌
,它的+2价离子的电子排布式为1s22s22p63s2sp63d10
1s22s22p63s2sp63d10
.(4)从图中可以看出,D踉B形成的离子化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
 (2011?咸阳模拟)[化学-选修物质结构与性质]
(2011?咸阳模拟)[化学-选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期也不在同一主族.B原子的L层有1对成对电子且其单质是空气的主要成分.C原子的L层p轨道中有5个电子;D是周期表中1--18列中的第14列元素;D元素原子次外层电子数与最外层电子数之比为4:1. E跟C可形成离子化合物,其晶胞结构如右图.请回答:
(1)A与D形成的最简单化合物的分子式是
SiH4
SiH4
,该分子的立体构型是正四面体
正四面体
.该分子属于非极
非极
(填“极性”或“非极性”)分子(2)C与D形成的化合物晶体类型是
分子晶体
分子晶体
.B单质分子中含1
1
个σ键2
2
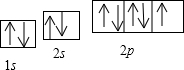
个π键(3)C的电子排布图

(4)从上图中可以看出,E踉C形成的化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是
| ||
| a3cm3 |
| ||
| a3cm3 |
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
①估计钙元素的电负性的取值范围:
0.8
0.8
<X<1.2
1.2
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于17时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlC13中形成的化学键的类型及其理由是
共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
.[选修一物质结构与性质]
有X、Y、Z、Q、M、E、N、G前四周期且原子序数递增的八种元素,其中X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素基态原子核外有两个电子层,最外层有3个未成对电子,Q的基态原子核外成对电子数是成单电子数的3倍,E原子得到一个电子后3p轨道全充满,G+中所有电子正好全部充满K、L、M三个电子层.M、N原子的价层电子构型为nS1,其电离能数据如下表:
回答下列问题:
(1)Z元素原子的价层电子的轨道表示式为:
 ;
;
(2)由X、Y形成的Y2X2分子中,含有
(3)比较ME、NE的熔点高低并说明理由
(4)Y、Z、Q的第一电离能由小到大的顺序为
(5)YQ2中心原子的杂化方式为
 .
.
(6)GE的晶胞结构如图所示,阴离子周围最近的阳离子有
(只要求列出计算式).
查看习题详情和答案>>
有X、Y、Z、Q、M、E、N、G前四周期且原子序数递增的八种元素,其中X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素基态原子核外有两个电子层,最外层有3个未成对电子,Q的基态原子核外成对电子数是成单电子数的3倍,E原子得到一个电子后3p轨道全充满,G+中所有电子正好全部充满K、L、M三个电子层.M、N原子的价层电子构型为nS1,其电离能数据如下表:
| M | N | |
| 第一电离能(kJ/mol) | 495.8 | 418.8 |
(1)Z元素原子的价层电子的轨道表示式为:


(2)由X、Y形成的Y2X2分子中,含有
3
3
个O-键,2
2
个π键:(3)比较ME、NE的熔点高低并说明理由
NaCl熔点高于KCl,Na+半小小于K+,Na+与Cl-形成的离子键强于K+与Cl-形成的离子键(或NaCl晶格能高于KCl)
NaCl熔点高于KCl,Na+半小小于K+,Na+与Cl-形成的离子键强于K+与Cl-形成的离子键(或NaCl晶格能高于KCl)
.
(4)Y、Z、Q的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(用元素符号回答)(5)YQ2中心原子的杂化方式为
sp
sp
,有一种与YQ2互为等电子体的离子,能用于鉴别Fe3+,写出其电子式

(6)GE的晶胞结构如图所示,阴离子周围最近的阳离子有
4
4
个;GE晶体的密度为ag?cm-3,则晶胞的体积是| 4×99.5g/mol |
| ag/cm3×6.02×1023mol-1 |
| 4×99.5g/mol |
| ag/cm3×6.02×1023mol-1 |