2.氯气的特性--氯气跟水的反应
(1).预测氯气可能与水反应
(2).实验设计:①.取三支盛氯水的试管,
分别向其中加入镁条、石蕊溶液、硝酸银溶液, 图2-3
观察现象(如图2-3)。
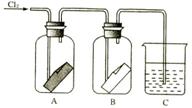 ②.将干燥的氯气依次通过盛有干燥红纸条
②.将干燥的氯气依次通过盛有干燥红纸条
的集气瓶A中和盛有湿润红纸条的集气瓶B中,
观察现象(如图2-4)。
 图2-4
图2-4
(3).实验记录:
|
实验内容 |
实验现象 |
实验结论 |
|
氯水与镁 |
生成气体 |
氯水中含酸 |
|
氯水与石蕊溶液 |
先变红后褪色 |
氯水中含酸,也含有漂白性物质 |
|
氯水与硝酸银溶液 |
生成白色沉淀 |
氯水中含有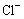 |
|
氯气与干燥红纸条 |
红纸条不褪色 |
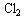 无漂白作用 无漂白作用 |
|
氯气与湿润红纸条 |
红纸条褪色 |
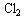 和H2O的反应产物有漂白作用 和H2O的反应产物有漂白作用 |
(4).整合结论:
①.Cl2不仅能溶解于水,还能与水反应生成盐酸和次氯酸, 具有漂白性,反应的化学方程式是: 。
②.新制取的氯水中含有的微粒:分子: 、 、 ;
离子:
、
、 。(由于HClO见光易分解:2HClO 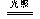 2HCl+O2↑,久置的氯水变成稀盐酸)
2HCl+O2↑,久置的氯水变成稀盐酸)
[质疑激趣]:Cl2跟水反应生成两种酸,则Cl2是否也与碱液反应?

 例1.按图2-5所示的方法研究某气体的性质,这种方法属于( )
例1.按图2-5所示的方法研究某气体的性质,这种方法属于( )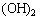 =
=
 2FeCl3; Cl2+Cu
2FeCl3; Cl2+Cu 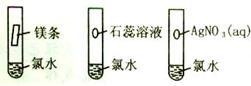 [质疑激趣]:除了上述与氧气类似的性质外,氯气还具有什么特性呢?
[质疑激趣]:除了上述与氧气类似的性质外,氯气还具有什么特性呢? (2).取一支盛满氯气的试管,将其倒扣在水槽中,
(2).取一支盛满氯气的试管,将其倒扣在水槽中,