25、某核素ZAX的氯化物XCl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数A的值。
(2)若X的核内中子数为20,求37gXCl2中所含质子的物质的量是多少?
 长沙市第一中学高一下学期第一次月考答卷
长沙市第一中学高一下学期第一次月考答卷
|
2009 年3月 |
年级 |
高一 |
科 目 |
化 学 |
时 量 |
90 分钟 |
满 分 |
100分 |
可能用到的相对原子质量:H-1 Cl-35.5
(8分)22、A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。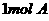 的单质跟足量的
的单质跟足量的 反应可置换出
反应可置换出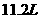 (标准状况下)的氢气,这时A转变成与氖原子具有相同电子层结构的离子。
(标准状况下)的氢气,这时A转变成与氖原子具有相同电子层结构的离子。
试回答:
(1)A、B、C分别是 元素(填写元素名称)。
(2)分别写出A、B最高正价氧化物对应水化物跟C的气态氢化物的水溶液反应的离子方程式 , 。
(3)A离子的氧化性比B离子氧化性 。
(8分)23、下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.70 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中的位置是 。
(2)写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应: ;
②R2X2与ZX2反应: 。
(3)X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
24、某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴,还缺少的仪器有
(3)实验内容:(填写与实验步骤对应的实验现象的编号及此实验的结论)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
|
|
|
|
|
|
此实验的结论是为
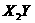 为离子化合物,化学式是
,若
为离子化合物,化学式是
,若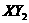 为共价化合物,其化学式是
。
为共价化合物,其化学式是
。