0 18868 18876 18882 18886 18892 18894 18898 18904 18906 18912 18918 18922 18924 18928 18934 18936 18942 18946 18948 18952 18954 18958 18960 18962 18963 18964 18966 18967 18968 18970 18972 18976 18978 18982 18984 18988 18994 18996 19002 19006 19008 19012 19018 19024 19026 19032 19036 19038 19044 19048 19054 19062 447348
 2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O
2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O

 生成的ClO2和CO2混合气体的物质的量为:n(气) ==
生成的ClO2和CO2混合气体的物质的量为:n(气) == 2ClO2↑+ 2CO2↑+ K2SO4 + 2H2O
2ClO2↑+ 2CO2↑+ K2SO4 + 2H2O


 ==
==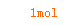





 甲组:药片
白色沉淀 灰绿色沉淀
红褐色沉淀
甲组:药片
白色沉淀 灰绿色沉淀
红褐色沉淀



 乙组:药片
淡黄色浑浊液
淡红色溶液
红色加深,有气
乙组:药片
淡黄色浑浊液
淡红色溶液
红色加深,有气