摘要:31.ClO2是一种消毒杀菌效率高.二次污染小的水处理剂.实验室中可通过以下反应制得ClO2: 2KClO3 + H2C2O4 + H2SO4 2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O (1)该反应中氧化剂是KClO3 (2)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量和物质的量. 解:设参加反应H2C2O4的物质的量为x 生成的ClO2和CO2混合气体的物质的量为:n(气) == == 1mol 2KClO3 + H2C2O4 + H2SO4 2ClO2↑+ 2CO2↑+ K2SO4 + 2H2O 1mol 4mol X 1mol == X=0.25mol 参加反应H2C2O4的质量为:m(H2C2O4) == n(H2C2O4)×M(H2C2O4) == 0.25mol×90g •mol-1 == 22.5g 答:参加反应的 H2C2O4的质量为22.5g物质的量为0.25mol 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_189653[举报]
ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
(1)H2C2O4中碳元素化合价为
(2)该反应中氧化剂是
(3)若有24.5g KClO3参加反应时,反应中转移的电子数为
(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
查看习题详情和答案>>
| ||
(1)H2C2O4中碳元素化合价为
+3
+3
,ClO2中氯元素化合价为+4
+4
;(2)该反应中氧化剂是
KClO3
KClO3
,被氧化的元素是C
C
;(3)若有24.5g KClO3参加反应时,反应中转移的电子数为
0.2NA
0.2NA
;(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4  2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
(1)H2C2O4中碳元素化合价为______,ClO2中氯元素化合价为______;
(2)该反应中氧化剂是______,被氧化的元素是______;
(3)若有24.5g KClO3参加反应时,反应中转移的电子数为______;
(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
查看习题详情和答案>>
ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
(1)H2C2O4中碳元素化合价为______,ClO2中氯元素化合价为______;
(2)该反应中氧化剂是______,被氧化的元素是______;
(3)若有24.5g KClO3参加反应时,反应中转移的电子数为______;
(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
查看习题详情和答案>>
| ||
(1)H2C2O4中碳元素化合价为______,ClO2中氯元素化合价为______;
(2)该反应中氧化剂是______,被氧化的元素是______;
(3)若有24.5g KClO3参加反应时,反应中转移的电子数为______;
(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 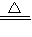 2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
(1)H2C2O4中碳元素化合价为______,ClO2中氯元素化合价为______;
(2)该反应中氧化剂是______,被氧化的元素是______;
(3)若有24.5g KClO3参加反应时,反应中转移的电子数为______;
(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
查看习题详情和答案>>
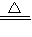 2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)(1)H2C2O4中碳元素化合价为______,ClO2中氯元素化合价为______;
(2)该反应中氧化剂是______,被氧化的元素是______;
(3)若有24.5g KClO3参加反应时,反应中转移的电子数为______;
(4)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量.
查看习题详情和答案>>
自然界中的水要经过消毒杀菌才可成为生活饮用水.ClO2是一种高效安全灭菌消毒剂,其中Cl化合价为+4价.
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 .
(2)下列可用作比较S和C非金属性强弱依据的是 .
A.CS2中各元素的化合价
B.气态氢化物的稳定性
C.元素在周期表中的位置
D.最高价含氧酸的酸性
(3)以下性质的比较正确的是 .
A.键长:HF>HCl
B.稳定性:HF>HCl
C.酸性:HF>HCl
D.沸点:HF>HCl
(4)O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3═O2+[O]-Q平衡常数为K1;
反应②[O]+O3═2O2+Q平衡常数为K2;
总反应:2O3═3O2+Q平衡常数为K.
一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.在30°C、pH=4.0条件下,O3的分解速率为 mol/(L?min).
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为 .(填字母代号)
A.40°C、pH=3.0
B.10°C、pH=4.0
C.30°C、pH=7.0
(6)下列叙述正确的是 .
A.降低温度,K增大
B.K=K1+K2
C.适当升温,可提高消毒效率
D.压强增大,K2减小.
查看习题详情和答案>>
(1)氯原子最外层有
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价
B.气态氢化物的稳定性
C.元素在周期表中的位置
D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl
B.稳定性:HF>HCl
C.酸性:HF>HCl
D.沸点:HF>HCl
(4)O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3═O2+[O]-Q平衡常数为K1;
反应②[O]+O3═2O2+Q平衡常数为K2;
总反应:2O3═3O2+Q平衡常数为K.
一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.在30°C、pH=4.0条件下,O3的分解速率为
| T/℃t/min pH | 3.0 | 4.0 | 5.0 | 6.0 | 20 | 301 | 231 | 169 | 58 | 30 | 158 | 108 | 48 | 15 | 50 | 31 | 26 | 15 | 7 |
A.40°C、pH=3.0
B.10°C、pH=4.0
C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大
B.K=K1+K2
C.适当升温,可提高消毒效率
D.压强增大,K2减小.