22.(11分)利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是甲烷、甲醇、肼、氨等。肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水,回答下列问题:
(1)利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:
,并指出电解质溶液中OH-离子向 极移动。
若用该燃料电池电解饱和食盐水得C12 7.1g,则需肼 g,若想将电解后饱和食盐水恢复原状,需 。
(2)用电离方程式表示肼的水溶液呈碱性的原因 ;
(3)天然气有着来源广,污染小的优点,但未能在汽车燃料中推广应用,而其催化氧化产物甲醇却被推广使用,主要是因为 。
(4)如果将燃料改为汽油则为汽油燃料电池,该燃料电池最大的障碍是氧化反应不完全产生
堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
(5)肼是强还原剂,与氧化剂H2O2反应时可放出大量的热,因此,肼可以作为火箭推进剂。
某些共价键的键能
|
键 |
键能/kJ·mol-1 |
键 |
键能/kJ·mol-1 |
键 |
键能/kJ·mol-1 |
|
N-N |
193 |
N=N |
418 |
N≡N |
946 |
|
O-O |
142 |
O=O |
497 |
H-H |
436 |
|
N-H |
391 |
O-H |
463 |
|
|
根据以上信息,试写出肼与H2O2反应的热化学方程式 。
21. (8分)某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据:(表中某些数据记录已模糊不清,个别数据已丢失。)
 实验 实验序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
v(H2SO4) /mL |
溶液温度/°C |
金属消失的时间/s |
|
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
数据模糊 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
数据模糊 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
数据模糊 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
数据模糊 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
数据丢失 |
44 |
40 |
若实验操作、数据记录均是正确的,请分析上述数据,回答下列问题:
(1)该实验主要是探究 因素对反应速率的影响。
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理。
(3)试猜测实验9反应前溶液的温度约为 °C。推测的依据是 。
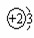 A.原子结构示意图为 B.原子核内中子数为3
A.原子结构示意图为 B.原子核内中子数为3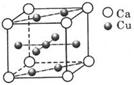 (9分)铜及其合金是人类最早使用的金属材料。
(9分)铜及其合金是人类最早使用的金属材料。