30.某实验小组欲用10克胆矾(CuSO4·5H2O)制取氧化铜并证明氧化铜能加快H2O2的分解。
Ⅰ.请你完成他们制取氧化铜的实验步骤。(提示:氢氧化铜受热分解生成氧化铜和水)
(1)称取10克胆矾,将其放入小烧杯中,再 ▲ 。
(2)向步骤(1)中的烧杯内滴加一定量的 ▲ 溶液,产生大量的沉淀。
(3)将步骤(2)所得混合物过滤、洗涤。
(4)检验滤液中是否含硫酸铜,操作方法是 ▲ 。
(5)检验步骤(3)固体残渣是否洗涤干净,操作方法是 ▲ 。
(6)将洗涤干净的固体残渣加热直至全部变为黑色的氧化铜。
Ⅱ.小明设计了右图实验装置来证明氧化铜能加快双氧水(溶质质量分数约5%)的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
|
序号 |
双氧水体积 |
催化剂 |
待测数据 |
|
① |
15mL |
无 |
|
|
② |
15mL |
CuO(0.5g) |
|
|
③ |
15mL |
MnO2(0.5g) |
|
(1)从设计装置来看,有一个明显的缺陷,你认为如何纠正 ▲ 。
(2)从设计原理看,实验中的“待测数据”可以是指 ▲ 。
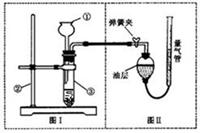 (3)实验时气体收集在图Ⅱ的球型漏斗中。若
(3)实验时气体收集在图Ⅱ的球型漏斗中。若
要保证读取的气体体积没有误差,在读数
前应进行的操作是 ▲ 。若要检验
产生的气体是氧气,应打开单孔橡皮塞,
▲ 。
(4)为探究CuO在实验②中是否起催化作用,
除与①比较外,还需补做下列实验(不必
写具体操作):a.证明CuO的化学性质没有改变;b. ▲ 。
(5)如果三个实验中所用双氧水溶质质量分数不同,对实验结果 ▲ (选填“有”或“没有”)明显影响。
Ⅲ.(1)写出双氧水在氧化铜的催化作用下分解产生氧气的方程式 ▲ 。
(2)已知该双氧水中溶质质量分数为5%,若产生氧气0.16g,那实际消耗的过氧化氢溶液质量是多少?(要有计算过程)
 )能转变成制造计算机芯片的物质硅(
)能转变成制造计算机芯片的物质硅(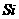 ),化学反应原理是
),化学反应原理是 高温
高温 该反应的基本类型为
该反应的基本类型为 下列实验操作中,正确的是
下列实验操作中,正确的是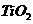 )是常用的小食品添加剂,它属于
)是常用的小食品添加剂,它属于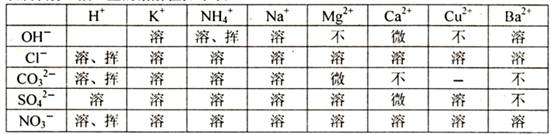 说明:表中“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“一”表示不稳定或不存在。
说明:表中“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“一”表示不稳定或不存在。 常见金属的活动性顺序如下:
常见金属的活动性顺序如下: