27.(15分)新型材料纳米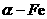 粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,
粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,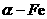 粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
(1)在高温下,装置B中发生反应的化学方程式是 。
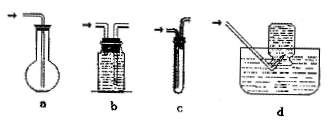
(2)请在下列装置中选择满足虚线框图C的气体收集装置 。
(3)该小组同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
[查阅资料]该小组同学通过资料得知,固体产物中一般不会同时出现三种形态混合物组合。
[提出假设]
假设1:全部为氧化亚铁;
假设2:全部为四氧化三铁;
假设3:铁和氧化亚铁混合物;
假设4:铁和四氧化三儿混合物;
假设5: 。
[设计方案]小组成员讨论后对假设4提出实验方案(不要在答题卡上作答)
[实验过程]
根据上述设计的方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
实验操作 |
实验现象 |
|
Ⅰ |
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入适量盐酸,微热 |
黑色粉末全部溶解,溶液呈 ,有少量气泡产生 |
|
Ⅱ |
向实验Ⅰ中得到的溶液加几滴KSCN溶液,振荡 |
溶液不显血红色 |
[交流讨论]①实验步骤Ⅱ加入 KSCN后溶液不显血红色的原因 。
 ②继续向Ⅱ溶液中加稀硝酸,立即出现血色,写出该过程中发生变化的离子方程式
。
②继续向Ⅱ溶液中加稀硝酸,立即出现血色,写出该过程中发生变化的离子方程式
。
26.(12分)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:
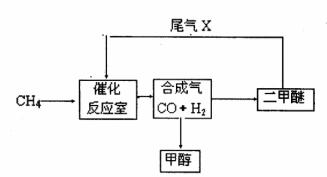
(1)写出用合成气生产二甲醚的化学方程式 。
 (2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
。
(3)工业上一般采用下列两种反应合成甲醇:
 反应Ⅰ: CO(g)+2H2(g)
CH3OH(g)
反应Ⅰ: CO(g)+2H2(g)
CH3OH(g) 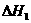
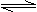 反应Ⅱ:CO2(g)+3H2(g)
CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g)
CH3(g)+H2O(g)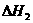
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250 |
300 |
350 |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断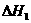 0(填“>”、“=”、“<”)。
0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+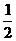 O2(g)
O2(g) CO2(g)+2H2(g) 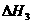 =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+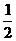 O2(g)
O2(g) H2O(g) 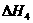 =-241.8kJ·mol-1
=-241.8kJ·mol-1
则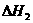 =
。
=
。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式 。
 出生率和死亡率对种群的大小和种群密度起决定作用
出生率和死亡率对种群的大小和种群密度起决定作用
 在观察洋葱细胞有丝分裂实验中,将已解离、漂洗、染色的根尖置于载玻片k@s^5*u上,轻轻盖k@s^5*u上盖玻片后即可镜检
在观察洋葱细胞有丝分裂实验中,将已解离、漂洗、染色的根尖置于载玻片k@s^5*u上,轻轻盖k@s^5*u上盖玻片后即可镜检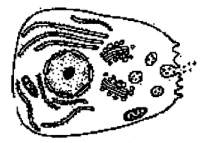
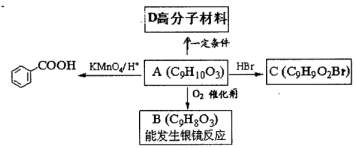 乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化: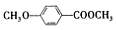 ②写出两分子A在浓H2SO4存在下加热,生成八元环状化合物的
。
②写出两分子A在浓H2SO4存在下加热,生成八元环状化合物的
。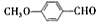 (3)乙基香草醛的另一种同分异构体E(
)是一种医药中间体。某兴趣小组提出用茴香醛(
)为基本原料通过2步合成E。指出该流程中所涉及的化学反应类型
,
。
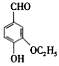
(3)乙基香草醛的另一种同分异构体E(
)是一种医药中间体。某兴趣小组提出用茴香醛(
)为基本原料通过2步合成E。指出该流程中所涉及的化学反应类型
,
。