0 123989 123997 124003 124007 124013 124015 124019 124025 124027 124033 124039 124043 124045 124049 124055 124057 124063 124067 124069 124073 124075 124079 124081 124083 124084 124085 124087 124088 124089 124091 124093 124097 124099 124103 124105 124109 124115 124117 124123 124127 124129 124133 124139 124145 124147 124153 124157 124159 124165 124169 124175 124183 447348

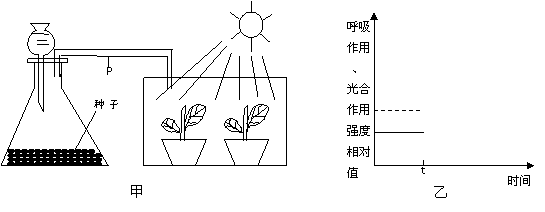 (10分)图甲装置为含水量较少的种子呼吸作用及幼苗光合作用实验图,图乙中的曲线表示种子呼吸作用(实线)和幼苗光合作用(虚线)的强度变化过程。请回答:
(10分)图甲装置为含水量较少的种子呼吸作用及幼苗光合作用实验图,图乙中的曲线表示种子呼吸作用(实线)和幼苗光合作用(虚线)的强度变化过程。请回答:
 试回答下列问题:
试回答下列问题: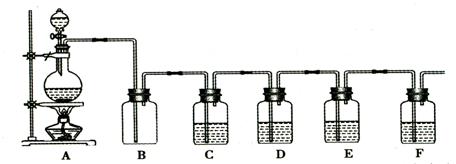 (15分)下图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
(15分)下图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答: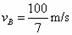 (18分)如图所示,与水平面成37°倾斜轨道AB,其沿直线在C点与半径R=1m的半圆轨道CD相切,全部轨道为绝缘材料制成且放在竖直面内。整个空间存在水平向左的匀强电场,MN的右侧存在垂直纸面向里的匀强磁场。一个质量为m=0.4kg的带电小球沿斜面AB下滑,至B点时速度为
,接着沿直线BC(此处无轨道)运动到达C处进入半圆轨道,进入时无动能损失,在小球到达D点,从D点飞出时磁场消失。不计空气阻力,g=10m/s2,cos37°=0.8,求:
(18分)如图所示,与水平面成37°倾斜轨道AB,其沿直线在C点与半径R=1m的半圆轨道CD相切,全部轨道为绝缘材料制成且放在竖直面内。整个空间存在水平向左的匀强电场,MN的右侧存在垂直纸面向里的匀强磁场。一个质量为m=0.4kg的带电小球沿斜面AB下滑,至B点时速度为
,接着沿直线BC(此处无轨道)运动到达C处进入半圆轨道,进入时无动能损失,在小球到达D点,从D点飞出时磁场消失。不计空气阻力,g=10m/s2,cos37°=0.8,求: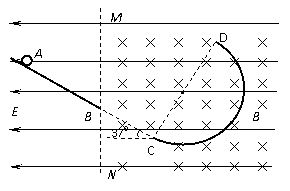
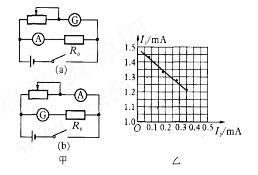
 在“验证机械能守恒定律”的实验中,已知打点计时器所用电源的频率为50Hz,查得当地的重力加速度g = 10.00rn/s2,实验中得到一条点迹清晰的纸带如图所示。选连续的4个点A,B,C,D,经测量知道A,B,C,D相邻两点间的距离分别为7.22cm, 7.58cm,7.97cm,根据以上数据,可知当打点计时器在纸带上打下B、C点时,重物的速度分别为vB=
,vc=
;若从B到C,重物重力势能的减少量为E1,动能的增加量为E2;则根据上面数据,其计算结果E1 E2(填大于小于等于)。
在“验证机械能守恒定律”的实验中,已知打点计时器所用电源的频率为50Hz,查得当地的重力加速度g = 10.00rn/s2,实验中得到一条点迹清晰的纸带如图所示。选连续的4个点A,B,C,D,经测量知道A,B,C,D相邻两点间的距离分别为7.22cm, 7.58cm,7.97cm,根据以上数据,可知当打点计时器在纸带上打下B、C点时,重物的速度分别为vB=
,vc=
;若从B到C,重物重力势能的减少量为E1,动能的增加量为E2;则根据上面数据,其计算结果E1 E2(填大于小于等于)。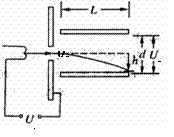 如图所示是示波管工作原理的示意图,电子经电压U1加速后以速度v0垂直进入偏转电场,离开电场时的偏转量为h
,两平行板间的距离为d,电势差为U2,板长为L.为了提高示波管的灵敏度(即每单位电压引起的偏转量h/U2),可采取的方法是:
如图所示是示波管工作原理的示意图,电子经电压U1加速后以速度v0垂直进入偏转电场,离开电场时的偏转量为h
,两平行板间的距离为d,电势差为U2,板长为L.为了提高示波管的灵敏度(即每单位电压引起的偏转量h/U2),可采取的方法是: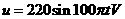 ,原、副线圈的匝数比为n1:n2=10:1,电阻R的阻值为100Ω,则1s内电阻R上产生的焦耳热为:
,原、副线圈的匝数比为n1:n2=10:1,电阻R的阻值为100Ω,则1s内电阻R上产生的焦耳热为: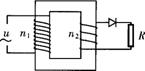 A.1.21 J
B.242 J
A.1.21 J
B.242 J