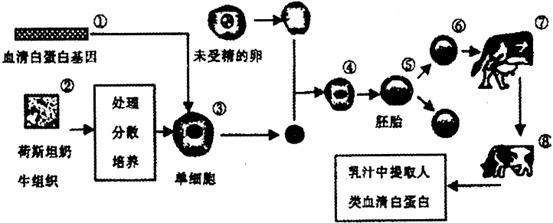
28.(16分) 钠是很活泼的金属,在空气中燃烧的产物是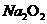 。
。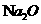 的制取可以通过如下反应完成:
的制取可以通过如下反应完成: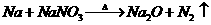 (未配平)。请回答下列问题:
(未配平)。请回答下列问题:
(1) 上述反应的氧化剂是
(写化学式)。制取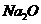 时若
时若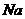 与
与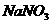 按质量
按质量
比23:17投料,充分反应后收集到的气体体积1.12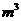 (标准状况下),则制得的
(标准状况下),则制得的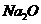 的质
的质
量为 kg。
(2) 制取 时由于设备密封性不好而进入了少量空气,导致制得的
时由于设备密封性不好而进入了少量空气,导致制得的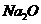 产品中含有
产品中含有
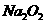 杂质。现有氧化钠样品mg (假设只含有
杂质。现有氧化钠样品mg (假设只含有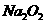 杂质),请根据下面可选用的仪器和试剂,设计一种实验仪器、试剂组合,以完成样品中氧化钠含量的测定。相关内容按要求填写在表格中。
杂质),请根据下面可选用的仪器和试剂,设计一种实验仪器、试剂组合,以完成样品中氧化钠含量的测定。相关内容按要求填写在表格中。
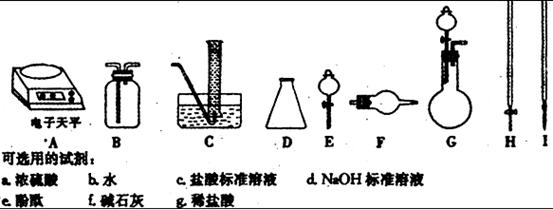
|
实验过程中发生反应的化学方程式 |
实验所需仪器(用字母表示) |
实验所需试剂(用字母表示) |
实验需直接测定的有关物理量(用文字说明) |
|
|
|
|
|
(3) 某学生设计了以下实验方案来测定该样品中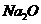 的质量分数,其操作流程和实验数据如下:
的质量分数,其操作流程和实验数据如下:

该氧化钠样品中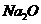 的质量分数为
。
的质量分数为
。
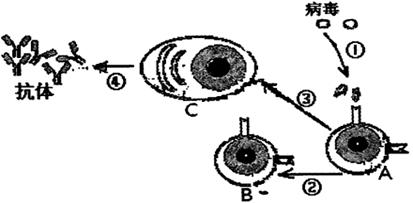
25.(13分) A、B、C、D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性
质信息如下表:
|
元素 |
结构或性质信息 |
|
A |
其原子最外层电子数是内层电子数的2倍 |
|
B |
基态原子最外层电子排布为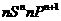 |
|
C |
非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
|
D |
单质在常温、常压下是气体。基态原子的M层上有1个未成对的P电子 |
|
E |
其与A形成的合金为目的用量最多的金属材料 |
(1) E元素基态原子的电子排布式是 。
(2) 在一定条件下,B与D可形成一种化合物 (分子中每个原子最外层均为8电子结构),常温下为淡黄色液体,该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:
。
(3) E单质在海水中易发生电化学腐蚀,写出该电化学腐蚀的正极电极反应式
。
(4) 己知1克单质C完全燃烧放出热量为Q KJ,写出表示C燃烧热的热化学方程式
。
(5) 比较A与C的电负性:A C
(填<,=或>)。A与D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是 。(填“ 键”
键”
或“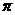 键”)。
键”)。
 ) 为主要原料来制备高锰酸钾,分两步进行:
) 为主要原料来制备高锰酸钾,分两步进行:
 条件下使+6价的锰歧化为+7价和+4价 (
条件下使+6价的锰歧化为+7价和+4价 (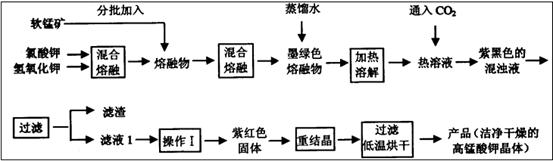
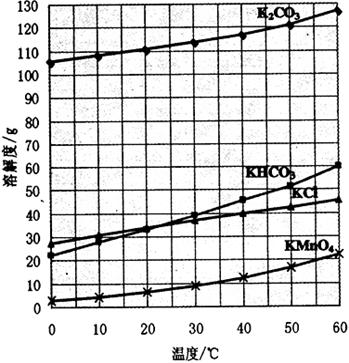
 溶液反应显紫色。
溶液反应显紫色。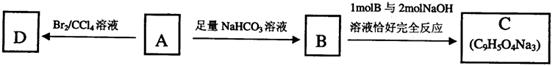
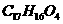 ,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为:
。
,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为:
。 坐标系内有垂直
坐标系内有垂直 轴上的P点开始运动。M粒子带电量为q,质量为m,初速度方向沿
轴上的P点开始运动。M粒子带电量为q,质量为m,初速度方向沿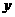 轴正方向,速度大小为
轴正方向,速度大小为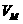 。运动轨迹如图所示。N粒子带电量为q,质量为
。运动轨迹如图所示。N粒子带电量为q,质量为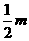 ,初速度方向是在
,初速度方向是在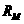 是多少?
是多少?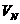 是多大?
是多大?
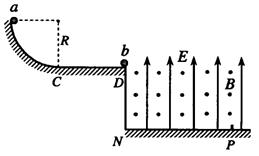 (16分)
(16分)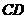 =2.0m的绝缘水平面平
=2.0m的绝缘水平面平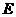 =40N/C,方向竖直向上,磁
=40N/C,方向竖直向上,磁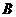 =1.0T,方向垂直纸面向外。两个
=1.0T,方向垂直纸面向外。两个 =2.0×
=2.0×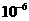 kg的小球
kg的小球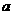 和
和 ,
,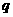 =1.0×l
=1.0×l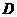 点与
点与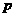 点。已知小球
点。已知小球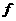 =0.1mg,
=0.1mg,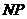 =
=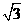
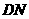 ,取g=l0m/
,取g=l0m/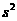 。
。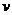 ;
;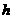 ;
;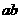 系统损失的机械能
系统损失的机械能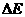 。
。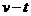 图像,试根据图像求:(g取10m/
图像,试根据图像求:(g取10m/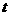 =1s时运动员的加速度和所受阻力的大小;
=1s时运动员的加速度和所受阻力的大小;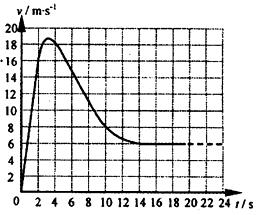
 ,然后将小铁锁拉离平衡位置一个小角度由静止释放,测出其多次全振动的时间,算出振动周期
,然后将小铁锁拉离平衡位置一个小角度由静止释放,测出其多次全振动的时间,算出振动周期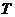 。多次改变悬线长并重复上面操作,得到多组
。多次改变悬线长并重复上面操作,得到多组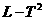 图像如图 (
图像如图 (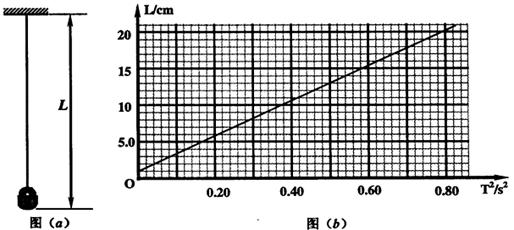
 的阻值:
的阻值:
 :阻值范围0-999.9
:阻值范围0-999.9
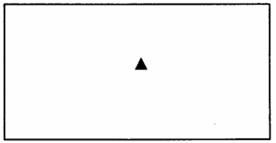
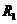 时,电压表读数为
时,电压表读数为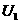 ;电阻箱读数为
;电阻箱读数为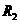 时,电压表读数为
时,电压表读数为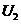 。用测定的实验数据写出计算待测电阻的表达式:
。用测定的实验数据写出计算待测电阻的表达式: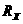 = ▲
。
= ▲
。