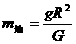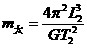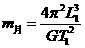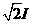26.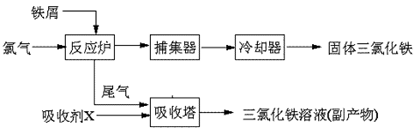 (14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为: ▲ 。
(2)已知六水合氯化铁在水中的溶解度如下:
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3・6H2O的方法是: ▲ 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ▲ mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)吸收剂X是: ▲ ;吸收塔中吸收剂X的作用是: ▲ 。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
(6)用FeCl3溶液(32%-35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+ – 2e- = 2Fe3+
阴极反应为: ▲ k* s* 5* u
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):
▲
|
|
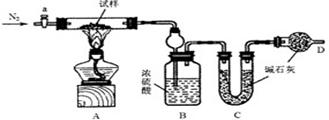 27.(14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
27.(14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
|
|||
 |
|||
|
|
|
①按图组装仪器,检查装置的气密性;k* s* 5* u
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1) 装置A中发生反应的化学方程式为 ▲
(2) 装置B的作用为 ▲
装置C的作用为 ▲
(3)实验过程中通入N2的目的为 ▲
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是( ▲ ) (填选项字母)
|

(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3) ▲ (填“能”或“不能”)。若能,则w(NaHCO3)的计算式为: ▲ ,若不能,此问不作答。
|
|
|
|
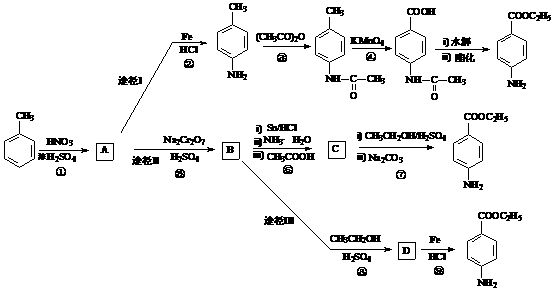
已知:①当苯环上连有甲基时,再引入的其它基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其它基团主要进入它的间位。
②苯胺(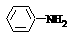 )分子中的氨基易被氧化。k* s* 5* u
)分子中的氨基易被氧化。k* s* 5* u
请回答下列问题:
(1)反应①的反应类型为 ▲ ,反应①除了主要生成A物质外,还可能
生成 ▲ 等副产物(写出一种副产物的结构简式即可)
(2)途经I中的步骤③的目的是 ▲
(3)已知化合物B的分子式为C7H5NO4,请写出B的结构简式: ▲ 。
(4)途径II中的步骤①和⑤能否互换,判断并说明理由: ▲ 。
(5)与途径II相比,途经I的缺点是步骤多,产率低。有同学受途径II的启发,自行设计了途径III,请写出反应⑧的化学方程式:
▲ 。
(6)苯佐卡因有多种同分异构体。其中有两个对位取代基,-NH2直接连在苯环上,分子结构中含有酯基的同分异构体有:
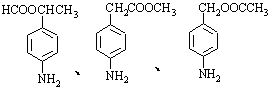
▲ 、 ▲ 。
25.(16分)下表为部分短周期元素化合价及相应氢化物沸点的数据:
|
元素性质 |
元素编号 |
|||||||
|
A |
B |
C |
D |
E |
F |
G |
H |
|
|
氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
|
最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
|
最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3,可用于制备强酸甲; ②B与D可形成化合物BD、BD2,可用于制备强酸乙。 请回答: (1)表中属于第三周期元素的是 ▲ (用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式: ▲
比较A、D、G三种简单阴离子的半径大小:r( ▲ )>r( ▲ )>r( ▲ ) (均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________▲_________。 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: ▲ 。
(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下: BD+BD2+Na2CO3=2 ▲ +CO2 ①横线上某盐的化学式应为 ▲ k* s* 5* u ②每产生44.8L(标准状况)CO2,被吸收尾气的质量是 ▲ g。
(6)请设计一个实验方案,使得铜和稀的强酸甲反应,得到蓝色溶液和氢气,在答题卡指定位置绘出实验装置图,作出必要的说明即可。
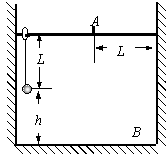
21.I(10分)
 如图所示,某同学为了测量截面为正三角形的三棱镜玻璃折射率,先在白纸上放好三棱镜,在棱镜的左侧插上两枚大头针P1和P2,然后在棱镜的右侧观察到 P1像和P2像,当P1的像被恰好被P2像挡住时,插上大头针P3和P4,使P3挡住P1、P2的像,P4挡住P3和P1、P2的像.在纸上标出的大头针位置和三棱镜轮廓如图所示。
如图所示,某同学为了测量截面为正三角形的三棱镜玻璃折射率,先在白纸上放好三棱镜,在棱镜的左侧插上两枚大头针P1和P2,然后在棱镜的右侧观察到 P1像和P2像,当P1的像被恰好被P2像挡住时,插上大头针P3和P4,使P3挡住P1、P2的像,P4挡住P3和P1、P2的像.在纸上标出的大头针位置和三棱镜轮廓如图所示。
(1)在答题纸的图上画出对应的光路;
(2)为了测出三棱镜玻璃材料的折射率,若以AB作为分界面,需要测量的量是 ▲ 和 ▲ ,在图上标出它们;
(3)三棱镜玻璃材料折射率的计算公式是n= ▲ 。 k* s* 5* u
(4)若在测量过程中,放置三棱镜的位置发生了微小的平移(移至图中的虚线位置底边仍重合),则以AB作为分界面,三棱镜材料折射率的测量值 ▲ 三棱镜玻璃材料折射率的真实值(填“大于”、“小于”、“等于”)。
II(12分)
现要测量某一电压表的内阻。给定的器材如下:
|
器材(代号) |
规格 |
|
待测电压表V1 |
量程1V,内阻约为10k W(待测) |
|
电压表V2 |
量程3V,内阻Rv2=6k W |
|
电流表(A) |
量程0.6A,内阻约为10 W |
|
三个固定电阻 |
R1=1 000 ,R2=3 000 ,R2=3 000 ,R3=10 000 ,R3=10 000 |
|
滑动变阻器(R4) |
最大电阻为100 W |
|
滑动变阻器(R5) |
最大电阻为10W |
|
电源E |
电动势6V,最大允许电流200mA |
|
开关(S)、导线若干 |
|
要求测量时电表指针偏转均超过其量程的一半。
(1)从3个固定电阻中只选用1个,与其它器材一起组成测量电路,并在答题纸的虚线框内画出测量电路的原理图。(要求电路中各器材用题中给定的符号标出。)
(2)写出实验中必须记录的数据(用符号表示),并指出各符号的意义 ▲ 。
 (3)用(2) 中记录的数据表示待测电压表内阻RV1的公式为RV1= ▲ 。
(3)用(2) 中记录的数据表示待测电压表内阻RV1的公式为RV1= ▲ 。
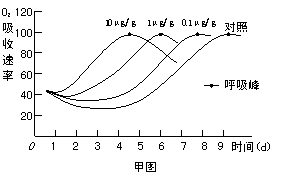 Ⅱ.(16分)果实成熟到一定程度时,乙烯含量明显上升。有些果实在这个时候呼吸速率会首先降低,然后突然增高,最后又下降,果实就完全成熟了,这个呼吸高峰称为呼吸峰。
Ⅱ.(16分)果实成熟到一定程度时,乙烯含量明显上升。有些果实在这个时候呼吸速率会首先降低,然后突然增高,最后又下降,果实就完全成熟了,这个呼吸高峰称为呼吸峰。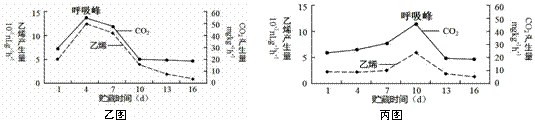
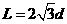 ,B板的右侧边缘恰好是倾斜挡板NM上的一个小孔K,NM与水平挡板NP成60°角,K与N间的距离
,B板的右侧边缘恰好是倾斜挡板NM上的一个小孔K,NM与水平挡板NP成60°角,K与N间的距离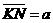 。现有质量为m带正电且电荷量为q的粒子组成的粒子束,从AB的中点O以平行于金属板方向OO'的速度v0不断射入,不计粒子所受的重力。
。现有质量为m带正电且电荷量为q的粒子组成的粒子束,从AB的中点O以平行于金属板方向OO'的速度v0不断射入,不计粒子所受的重力。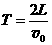 ,且粒子只在0~
,且粒子只在0~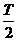 时间内入射,则能打到小孔K的粒子在何时从O点射入?
时间内入射,则能打到小孔K的粒子在何时从O点射入?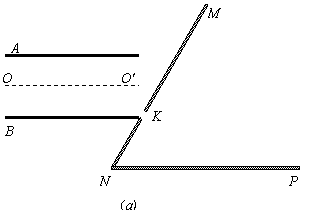 (3)在NM和NP两档板所夹的某一区域存在一垂直纸面向里的匀强磁场,使满足条件(2)从小孔K飞入的粒子经过磁场偏转后能垂直打到水平挡板NP上(之前与挡板没有碰撞),求该磁场的磁感应强度的最小值。
(3)在NM和NP两档板所夹的某一区域存在一垂直纸面向里的匀强磁场,使满足条件(2)从小孔K飞入的粒子经过磁场偏转后能垂直打到水平挡板NP上(之前与挡板没有碰撞),求该磁场的磁感应强度的最小值。
 (18分)如图所示,均可视为质点的三个物体A、B、C穿在竖直固定的光滑绝缘细线上,A与B紧靠在一起(但不粘连),C紧贴着绝缘地板,质量分别为MA=2.32kg,MB=0.20kg,MC=2.00kg,其中A不带电,B、C的带电量分别为qB = +4.0×10-5c,qC =+7.0×10-5c,且电量都保持不变,开始时三个物体均静止。现给物体A施加一个竖直向上的力F,若使A由静止开始向上作加速度大小为a=4.0m/s2的匀加速直线运动,则开始需给物体A施加一个竖直向上的变力F,经时间t 后, F变为恒力。已知g=10m/s2,静电力恒量k=9×109N·m2/c2,求:
(18分)如图所示,均可视为质点的三个物体A、B、C穿在竖直固定的光滑绝缘细线上,A与B紧靠在一起(但不粘连),C紧贴着绝缘地板,质量分别为MA=2.32kg,MB=0.20kg,MC=2.00kg,其中A不带电,B、C的带电量分别为qB = +4.0×10-5c,qC =+7.0×10-5c,且电量都保持不变,开始时三个物体均静止。现给物体A施加一个竖直向上的力F,若使A由静止开始向上作加速度大小为a=4.0m/s2的匀加速直线运动,则开始需给物体A施加一个竖直向上的变力F,经时间t 后, F变为恒力。已知g=10m/s2,静电力恒量k=9×109N·m2/c2,求: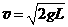 的速度向右运动,在A处环被挡住后立即停止。已知A离右墙的水平距离也为L,当地的重力加速度为
的速度向右运动,在A处环被挡住后立即停止。已知A离右墙的水平距离也为L,当地的重力加速度为 ,不计空气阻力。求:k+s-5#u
,不计空气阻力。求:k+s-5#u
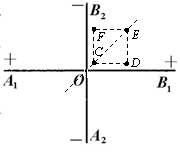 理论研究表明,无限大的均匀带电平面在周围空间会形成与平面垂直的匀强电场。现有两块无限大的均匀绝缘带电平板,正交放置如图所示,A1B1两面正电,A2B2两面负电,且单位面积所带电荷量相等(设电荷不发生移动)。图中直线A1B1和A2B2分别为带正电平面和带负电平面与纸面正交的交线,O为两交线的交点,C、D、E、F恰好位于纸面内正方形的四个顶点上,且CE的连线过O点。则下列说法中正确的是
理论研究表明,无限大的均匀带电平面在周围空间会形成与平面垂直的匀强电场。现有两块无限大的均匀绝缘带电平板,正交放置如图所示,A1B1两面正电,A2B2两面负电,且单位面积所带电荷量相等(设电荷不发生移动)。图中直线A1B1和A2B2分别为带正电平面和带负电平面与纸面正交的交线,O为两交线的交点,C、D、E、F恰好位于纸面内正方形的四个顶点上,且CE的连线过O点。则下列说法中正确的是