28.(14分)
某校化学兴趣小组为探究铜的常见化合物性质,提出了如下问题进行实验探究。请你协助该小组的同学完成下列探究活动。
[提出问题]
①CuO能否被NH3还原?
②如何安全地进行“钠投入CuSO4溶液反应”的实验?
[资料卡片]
Cu2O是红色粉末。Cu+在酸性溶液中能发生自身氧化还原反应生成Cu2+和Cu。
[实验方案]
(1)为解决问题①,设计的实验装置如下(夹持及尾气处理装置未画出):
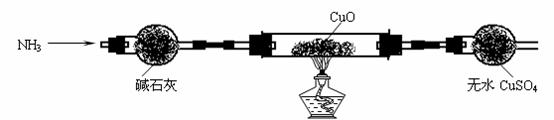
实验中观察到黑色CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。
(2)为解决问题②,该小组做了以下两组实验:
Ⅰ.分别取40mL 2%的硫酸铜溶液三份,各加入质量不同的钠块,实验现象如下:
|
钠块质量 |
实验现象 |
|
0.2 g |
钠块剧烈燃烧,发出爆炸声,少量的钠溅出 |
|
0.1 g |
钠块燃烧,发出爆炸声 |
|
0.05 g |
钠块四处游动,偶有轻微的爆炸声,未见钠块燃烧 |
Ⅱ.保持钠块大小相同(约为0.05 g),分别加入到不同浓度的硫酸铜溶液中,实验现象如下:
|
CuSO4溶液的浓度 |
实验现象 |
|
10% |
钠块投入后,马上剧烈燃烧起来,有爆炸声 |
|
5% |
钠块投入后,4-5s开始燃烧,有轻微的爆炸声 |
|
1% |
钠块投入后,过了36s开始燃烧,没有爆炸声 |
|
0.5% |
钠块投入后,过了40s开始燃烧,没有爆炸声 |
[实验结论]
(1)CuO能被NH3还原,该反应的化学方程式为_____________________________。
(2)在40mL 2%的硫酸铜溶液中,加入约 g的钠块是安全的。
[问题讨论]
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。你认为他的看法是否正确?________(填是或否),请你设计一个实验检验该红色物质中是否含有Cu2O。________________________________________________。
(2)从“钠与硫酸铜溶液反应”的实验结果来看,硫酸铜溶液浓度越大,越容易发生爆炸。你认为可能的原因是什么?提出猜想,并设计实验检验你的猜想。
猜想:_____________________________________________________________;
检验方案:_________________________________________________________。
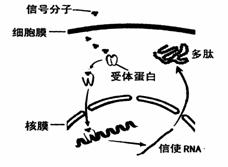 (1)不同的信号分子必须与相应的受体(化学本质多是糖蛋白)特异性结合方能发挥作用。下图是雌激素与相应受体结合情况示意图。
(1)不同的信号分子必须与相应的受体(化学本质多是糖蛋白)特异性结合方能发挥作用。下图是雌激素与相应受体结合情况示意图。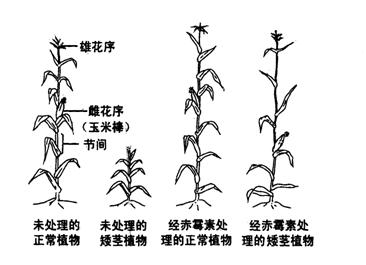 该小组进行的实验及结果如下图所示(注:图中植株均处于相同的生长时期)。由此能得出的结论是:
该小组进行的实验及结果如下图所示(注:图中植株均处于相同的生长时期)。由此能得出的结论是: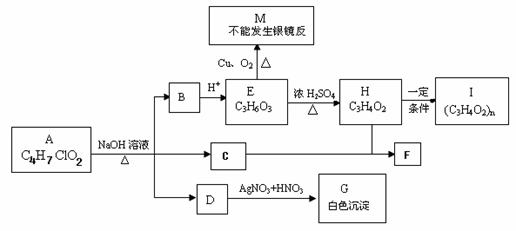
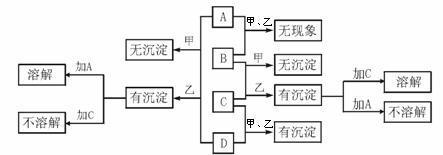
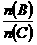 应符合的条件是______________。
应符合的条件是______________。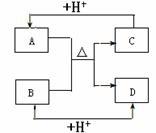 A、B、C、D四种常见粒子分别是由x、y、z三种元素中的两种构成,已知x、y、z均为短周期元素,且原子半径依次减小;A、B、C、D均含有相同数目的电子,其中A含有5个原子核,它们之间有如右图的转化关系:
A、B、C、D四种常见粒子分别是由x、y、z三种元素中的两种构成,已知x、y、z均为短周期元素,且原子半径依次减小;A、B、C、D均含有相同数目的电子,其中A含有5个原子核,它们之间有如右图的转化关系: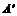 (0,L0)沿x轴正方向射出电场,其轨迹如图中虚线所示。不计粒子的重力及粒子间的相互作用。
(0,L0)沿x轴正方向射出电场,其轨迹如图中虚线所示。不计粒子的重力及粒子间的相互作用。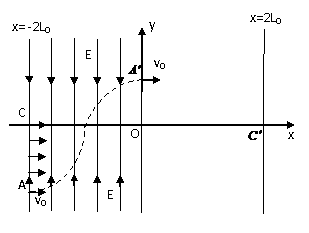 (3)若以直线x=2L0上的某点为圆心的圆形区域内,分布一垂直于xoy平面向里的匀强磁场,能使沿x轴正方向射出电场的粒子,经磁场偏转后,都通过直线x=2L0与圆形磁场边界的一个交点处,从而便于被收集。则该磁场区域的最小半径是多大?相应的磁感应强度B是多大?
(3)若以直线x=2L0上的某点为圆心的圆形区域内,分布一垂直于xoy平面向里的匀强磁场,能使沿x轴正方向射出电场的粒子,经磁场偏转后,都通过直线x=2L0与圆形磁场边界的一个交点处,从而便于被收集。则该磁场区域的最小半径是多大?相应的磁感应强度B是多大?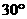 。滑轮O2的正下方桌面上放一与A相同的物块B,滑轮距桌面高为h。开始时用手托住P,使P、A均静止,细绳处于伸直状态。现放手让P下落,A向右运动,设A运动过程中始终没有离开桌面。问:
。滑轮O2的正下方桌面上放一与A相同的物块B,滑轮距桌面高为h。开始时用手托住P,使P、A均静止,细绳处于伸直状态。现放手让P下落,A向右运动,设A运动过程中始终没有离开桌面。问: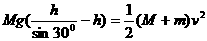 求得物块A到达O2正下方时的速度,你认为对吗?如对,接着进行下面的运算;如不对,请你给予正确的解答。
求得物块A到达O2正下方时的速度,你认为对吗?如对,接着进行下面的运算;如不对,请你给予正确的解答。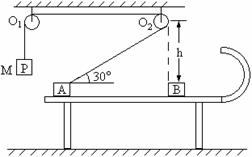 (2)物块A与物块B发生弹性碰撞,物块A的碰前速度用v0表示,碰后B恰能到达半圆轨道的最高点,求B运动过程中克服摩擦力所做的功。
(2)物块A与物块B发生弹性碰撞,物块A的碰前速度用v0表示,碰后B恰能到达半圆轨道的最高点,求B运动过程中克服摩擦力所做的功。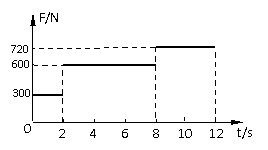 在四川汶川抗震救灾中,武警战士从直升飞机上通过一根竖直的长绳由静止开始滑下,经一段时间落地。某武警战士下滑过程中轻绳在竖直方向上对武警战士的作用力F随时间变化情况如图所示,不计空气阻力。已知该武警战士质量m=60kg,从开始下滑至脚触地,共经历12s。(在计算中武警战士可视为质点,g取10m/s2。)求:
在四川汶川抗震救灾中,武警战士从直升飞机上通过一根竖直的长绳由静止开始滑下,经一段时间落地。某武警战士下滑过程中轻绳在竖直方向上对武警战士的作用力F随时间变化情况如图所示,不计空气阻力。已知该武警战士质量m=60kg,从开始下滑至脚触地,共经历12s。(在计算中武警战士可视为质点,g取10m/s2。)求: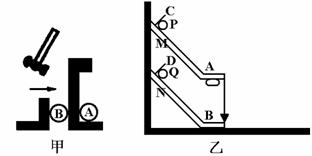 ②采用如图乙所示的装置,两个相同的轨道M、N,分别用于发射小铁球P、Q,其中M、N的末端水平,两轨道上端分别装有电磁铁C、D;调节电磁铁C、D的高度,使AC=BD,从而保证小铁球P、Q在轨道出口处的水平速度v0相等,现将小铁球P、Q分别吸在电磁铁C、D上,然后切断电源,使两小球能以相同的初速度v0同时分别从轨道M、N的下端A、B射出,实验可观察到的现象应是__________________。改变弧形轨道M的高度和电磁铁的位置(使AC=BD),重复上述实验,仍能观察到相同的现象,这说明________________________。
②采用如图乙所示的装置,两个相同的轨道M、N,分别用于发射小铁球P、Q,其中M、N的末端水平,两轨道上端分别装有电磁铁C、D;调节电磁铁C、D的高度,使AC=BD,从而保证小铁球P、Q在轨道出口处的水平速度v0相等,现将小铁球P、Q分别吸在电磁铁C、D上,然后切断电源,使两小球能以相同的初速度v0同时分别从轨道M、N的下端A、B射出,实验可观察到的现象应是__________________。改变弧形轨道M的高度和电磁铁的位置(使AC=BD),重复上述实验,仍能观察到相同的现象,这说明________________________。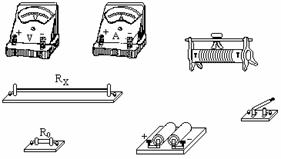 ④某次测量时,电压表示数为U,电流表示数为I,则该铜芯线材料的电阻率的表达式为___________。
④某次测量时,电压表示数为U,电流表示数为I,则该铜芯线材料的电阻率的表达式为___________。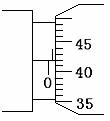
 某同学在实验室里熟悉各种仪器的使用。他将一条形磁铁放在水平转盘上,如图甲所示,磁铁可随转盘转动,另将一磁感应强度传感器固定在转盘旁边。当转盘(及磁铁)转动时,引起磁感应强度测量值周期性地变化,该变化的周期与转盘转动周期一致。经过操作,该同学在计算机上得到了如图乙所示的图像。
某同学在实验室里熟悉各种仪器的使用。他将一条形磁铁放在水平转盘上,如图甲所示,磁铁可随转盘转动,另将一磁感应强度传感器固定在转盘旁边。当转盘(及磁铁)转动时,引起磁感应强度测量值周期性地变化,该变化的周期与转盘转动周期一致。经过操作,该同学在计算机上得到了如图乙所示的图像。
