28.(14分)实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
|
化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
0.810 |
118.0 |
9 |
|
冰醋酸 |
1.049 |
118.1 |
∞ |
|
乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式: 、
。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是: 、
。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是 (填字母)。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
(4)将酯层采用如图所示装置蒸馏。
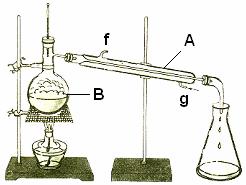
①写出图中仪器A的名称 ,冷却水从 口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在 ℃左右。
Ⅲ.计算产率
(5)测量分水器内由乙酸与正丁醇反应生成的水体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸正丁酯的产率是__________。
27.(15分)电解NaCl溶液(氯碱工业)所得产物均为化工生产中应用广泛的化工原料。请回答下列问题:
(1)写出电解NaCl溶液的离子反应式:
阳极________________________________,
总反应____________________________________________________________;
(2)常温下,将适量氯气通入NaOH溶液中可制得“漂白水”。若将等物质的量的氯气和NaOH反应,则所得溶液容易失效,写出该过程中发生反应的离子方程式____________________________________、____________________________________;
(3)已知氰酸的结构式为H-O-C≡N,在反应 KOCN+KOH+Cl2→CO2+N2+KCl+H2O (未配平)中,当有4molCO2生成时,被氧化的KOCN为__________mol;
(4)食醋总酸含量测定:①配制待测食醋溶液(稀释10倍);②待测食醋溶液装入酸式滴定管;③NaOH标准溶液装入碱式滴定管;④量取待测食醋溶液;⑤用NaOH标准溶液滴定待测食醋溶液;⑥数据处理(简略)
|
c(NaOH)=0.1010 mol·L-1 |
|||
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
V(CH3COOH)/mL |
25.00 |
25.00 |
25.00 |
|
V(NaOH)/mL |
16.30 |
16.08 |
16.10 |
在食醋溶液中滴加2滴__________作为指示剂,食醋总酸含量的平均值为(保留两位有效数字)__________(g/100mL)。
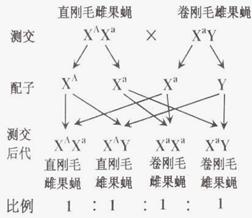 ②已知这只卷刚毛雄果蝇与直刚毛雌果蝇杂交,F1全部是直刚毛,F1雌雄果蝇随机交配,F2的表现型及比例是直刚毛雌果蝇:直刚毛雄果蝇:卷刚毛雄果蝇=2:1:1,此时最合理的假说是
。
②已知这只卷刚毛雄果蝇与直刚毛雌果蝇杂交,F1全部是直刚毛,F1雌雄果蝇随机交配,F2的表现型及比例是直刚毛雌果蝇:直刚毛雄果蝇:卷刚毛雄果蝇=2:1:1,此时最合理的假说是
。
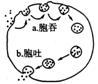 (1)右图表示动物细胞对大分子物质“胞吞”和“胞吐”的过程。a与b均要以
为基础才可能发生;a要有细胞识别和
才可能完成。甲状腺激素的分泌 (填:经过/不经过)b过程。
(1)右图表示动物细胞对大分子物质“胞吞”和“胞吐”的过程。a与b均要以
为基础才可能发生;a要有细胞识别和
才可能完成。甲状腺激素的分泌 (填:经过/不经过)b过程。
 方案:
方案:
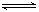 2NH3(g) △H=-92.4kJ·mol-1 氨气的用途有:生产铵盐、制纯碱、制硝酸、作制冷剂等。
2NH3(g) △H=-92.4kJ·mol-1 氨气的用途有:生产铵盐、制纯碱、制硝酸、作制冷剂等。