30.(14分)粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10一9 |
9.1×10一6 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
[设计除杂过程]
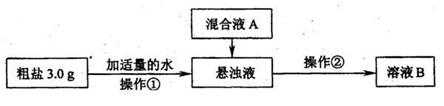
(1)操作①中需要使用的玻璃仪器有(i) 、(ii) 。操作②的名称为(iii) ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是(iv) ;
(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中。进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),如果没有沉淀生成,则Mg2+已除尽。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,如果没有沉淀生成,则Ca2+已除尽,效果最好的是 (填字母)。
A.Na2CO3 B.Na2SO4 C.NaOH
[获取纯净食盐]
(4)对溶液B加热并不断滴加l mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 ;用试纸测pH值的实验操作为 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
[问题讨论]
(6)进行操作②前,需先加热,其目的是
,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶解B中Mg2+物质的量浓度为 。
[选做部分]
共8个题,学生从中选择2个物理题、1个化学题和1个生物题作答。
29.(12分)请仔细观察两种电池的构造示意图,回答下列问题:
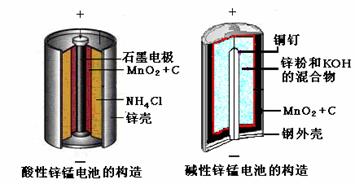
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式: 。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是
。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:
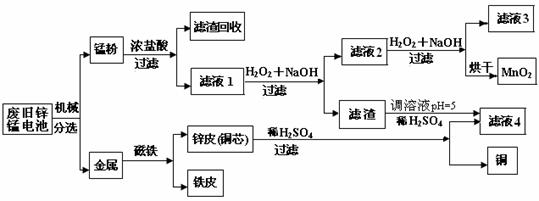
已知:生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、 。
② 滤液1先加入H2O2,而后调节pH=8.0,目的是
;
写出有关反应的离子方程式
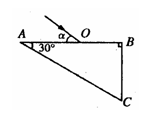 如图所示,ABC是由折射率为
如图所示,ABC是由折射率为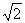 的某种透明物质制成的直角三棱镜截面(O为AB的中点),∠A=30°。一束光线在纸面内从O点射入棱镜,光线与AB面间的夹角为α。若不考虑光线在AB和BC面上的反射,则:
的某种透明物质制成的直角三棱镜截面(O为AB的中点),∠A=30°。一束光线在纸面内从O点射入棱镜,光线与AB面间的夹角为α。若不考虑光线在AB和BC面上的反射,则: 如图甲所示,用面积为s的活塞在汽缸内封闭着一定质量的空气,活塞上放一砝码,活塞和砝码的总质量为m。现对汽缸缓缓加热,使汽缸内的空气温度从T1升高到T2,空气柱的高度增加了△L,已知加热时气体吸收的热量为Q,外界大气压强为P0。 求:
如图甲所示,用面积为s的活塞在汽缸内封闭着一定质量的空气,活塞上放一砝码,活塞和砝码的总质量为m。现对汽缸缓缓加热,使汽缸内的空气温度从T1升高到T2,空气柱的高度增加了△L,已知加热时气体吸收的热量为Q,外界大气压强为P0。 求: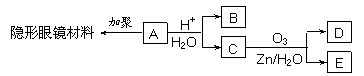 已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。