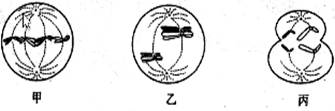
0 122974 122982 122988 122992 122998 123000 123004 123010 123012 123018 123024 123028 123030 123034 123040 123042 123048 123052 123054 123058 123060 123064 123066 123068 123069 123070 123072 123073 123074 123076 123078 123082 123084 123088 123090 123094 123100 123102 123108 123112 123114 123118 123124 123130 123132 123138 123142 123144 123150 123154 123160 123168 447348
 (4)为了确定耐盐转基因水稻是否培育成功,既要用放射性同位素标记的
作探针进行分子杂交检测,又要用
方法从个体水平鉴定水稻植株的耐盐性。
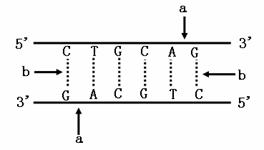
(4)为了确定耐盐转基因水稻是否培育成功,既要用放射性同位素标记的
作探针进行分子杂交检测,又要用
方法从个体水平鉴定水稻植株的耐盐性。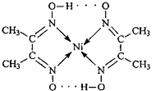
 (3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③
、④HCHO等,
①CH2=CH2、②CH≡CH、③
、④HCHO等,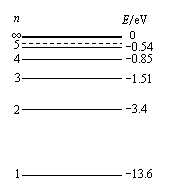 (物理--选修3-5)本题共有两小题,每小题6分,共12分。每小题给出的四个选项中,只有一项是符合题目要求的。
(物理--选修3-5)本题共有两小题,每小题6分,共12分。每小题给出的四个选项中,只有一项是符合题目要求的。 A.
A.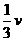 B.
B.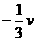
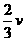 D.
D.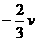

 .在科学研究中常用呼吸商(RQ=释放的二氧化碳体积/消耗的氧体积
.在科学研究中常用呼吸商(RQ=释放的二氧化碳体积/消耗的氧体积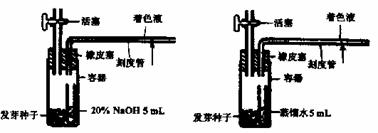 表示生物用于有氧呼吸的能源物 质不同。测定发芽种子呼吸商的装置如下图.
表示生物用于有氧呼吸的能源物 质不同。测定发芽种子呼吸商的装置如下图. CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。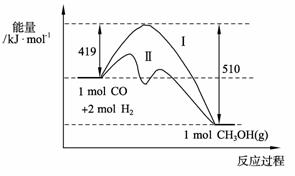
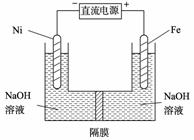 b. 使用催化剂, 能够提高反应物转化率
b. 使用催化剂, 能够提高反应物转化率
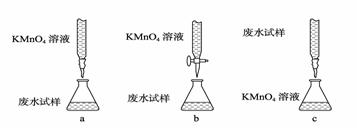
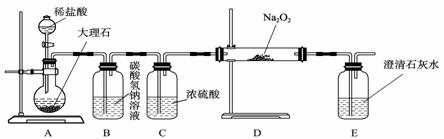
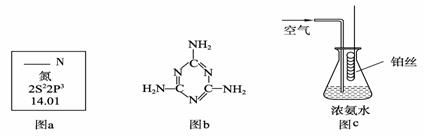
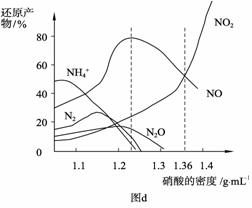 ② 当硝酸溶液的密度为1.36 g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是
(填序号)
② 当硝酸溶液的密度为1.36 g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是
(填序号)