30.[化学--物质结构与性质](13分)根据下列某些短周期元素中元素性质的有关句回答问题。
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径/10-10m |
0.37 |
1.86 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.52 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
|
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
|
|
最低价态 |
-1 |
|
-2 |
|
-4 |
-3 |
-1 |
|
-3 |
-1 |
(1)元素①、②和⑧的第一电离能由大到小的顺序是_________(填元素符号);元素③、⑥和⑨的氢化物中沸点由高到低的顺序是__________(填化学式)。
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都 满足最外层为8电子稳定结构的物质有__________(写化学式)。
(3)某元素R的原子半径为1.02×10-10m,它与钠形成Na2R2,其化学键类型有________,其电子式是_________(R用元素符号表示)。
(4)元素①和⑨形成阳离子 ,其结构式为_________,其中心原子以_______杂化轨道成键。
(5)元素⑤的原子基态电子排布式为____________。
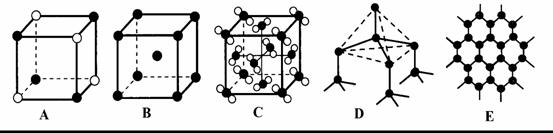
(6)元素②和⑦形成晶体的部分结构可用下图中的______来表示(填序号)。
26. (25分)请回答I、II题:
I、(10分)为探究环境因素对植物光合作用的影响,某同学进行了如下实验。所用材料和用具包括:符合实验条件的黑藻若干,蒸馏水,试管,25瓦、50瓦、100瓦的日光灯,精密pH试纸。请完成下列实验步骤并回答问题:
(注:默认实验中任意光照强度下,光合作用都大于呼吸作用) (1)实验步骤: ①在25℃条件下,将符合实验条件的黑藻平均分成若干组,放入相应的试管中并编号,加入等量蒸馏水浸没黑藻。 ②在黑暗条件下放置一段时间,用___________测定试管中水的pH,待其相对稳定时,记录数值。 ③将试管分别移到25瓦、50瓦、100瓦的日光灯下光照,每5分钟测定pH并记录一次,一段时间后,pH重新处于相对稳定状态。 (2)此实验的目的是探究_______________对黑藻光合作用的影响。 (3)此实验依据的原理是:当光合作用大于呼吸作用,黑藻吸收二氧化碳,使水中pH升高,通过测定不同光照条件下水中_____的变化,间接了解二氧化碳的消耗程度,以此探究不同光照强度对光合作用的影响。 (4)考虑到水中pH变化会受到非生物因素的影响,上述实验设计还应该补充________实验。具体做法是另取三支试管分别加入_______________________________,然后重复②③步骤。
II、(15分)当人体血糖发生变化,可以直接刺激胰岛细胞,也可通过刺激下丘脑来刺激胰岛细胞,从而影响相关的激素的分泌,实现血糖的平衡调节。下图中“变化甲”、“变化乙”指的是血糖浓度的升高或下降,“X”指的是下丘脑。请据图和所学相关知识回答下列问题:

|
25.(15分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是: 。
(2)简述强调“测得的pH小于7”的理由: 。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,如果观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色。请用离子方程式解释这一现象产生的原因:
。
由此说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就不会出现红色。该小组同学接着又做了对比实验:取3mol/L NaOH溶液,加入酚酞溶液后不显红色,加水稀释后,红色逐渐出现且不褪去,即可证明上述意外现象是因为取用的NaOH溶液浓度过大。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
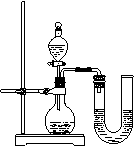 该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
|
编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
|
1 |
3.65﹪ |
2.00﹪ |
3.5 |
|
2 |
3.65﹪ |
4.00﹪ |
x |
|
3 |
7.30﹪ |
8.00﹪ |
14 |
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学
根据 (填实验现象)判断NaOH溶液与稀盐酸发生了中和反应。

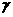 光子。已知质子、中子、氘核的质量分别为m1、m2、m3,普朗克常量为h,真空中的光速为c。下列说法正确的是 (填选项前的编号)
光子。已知质子、中子、氘核的质量分别为m1、m2、m3,普朗克常量为h,真空中的光速为c。下列说法正确的是 (填选项前的编号)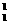 H+
H+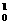 n
n
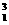 H+γ
H+γ 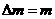 1+m2-m3
1+m2-m3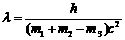
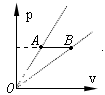 (1).如右图所示为一定质量的理想气体的P-V图,若使气体从图中的状态
A变化到状态B,则 (填选项前的编号)
(1).如右图所示为一定质量的理想气体的P-V图,若使气体从图中的状态
A变化到状态B,则 (填选项前的编号) (2) 在均匀玻璃管中有一段10cm长的水银柱,封住了一定质量的理想气体。若管口向下将玻璃管放置在一个倾角为30°的斜面上不动(如图所示),管内气体长度为8.5cm;如果管口向上竖直放置,管内气体长度为:
(填选项前的编号)
(2) 在均匀玻璃管中有一段10cm长的水银柱,封住了一定质量的理想气体。若管口向下将玻璃管放置在一个倾角为30°的斜面上不动(如图所示),管内气体长度为8.5cm;如果管口向上竖直放置,管内气体长度为:
(填选项前的编号)