6.其他单质、氧化物、酸、碱、盐的除杂方法:
|
操作方法 |
示
例 |
|||||
|
物 理 方 法 |
过滤法 |
粗盐提纯(只除去不溶性杂质)、Na2CO3(可溶)与CaCO3(不溶)混合物分离 |
||||
|
结晶法 |
粗盐提纯实验中滤液蒸发得NaCl晶体--[蒸发结晶] NaCl与KNO3混合物的分离------[降温结晶:KNO3析出] |
|||||
|
磁吸法 |
分离铁粉与铜粉的混合物[铁粉被磁铁吸引,铜粉未被吸引] |
|||||
|
化 学 方 法 |
沉淀法 |
除去NaCl中混有的Na2SO4:[加BaCl2溶液]Na2SO4+BaCl2=BaSO4↓+2NaCl KNO3(KCl)[加AgNO3溶液]:KCl+AgNO3= AgCl↓+KNO3 [转化] |
||||
|
气化法 |
除去NaCl中混有的Na2CO3:[加稀HCl溶液] [转化] Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaCl(NH4Cl):[加NaOH溶液]NH4Cl+NaOH= NaCl+NH3↑+H2O |
|||||
|
置换法 |
除去FeSO4中混有的CuSO4:[加Fe粉]CuSO4+Fe=FeSO4+Cu[转化] |
|||||
|
吸收法 |
除去CO中混有的少量CO2:[通过NaOH溶液]2NaOH+CO2 = Na2CO3+H2O [CO2(CO):[通过灼热的CuO] CuO+CO △Cu+CO2] [转化] |
|||||
|
加热法 |
除去CaO中混有的CaCO3:[高温]CaCO3
高温 CaO+CO2↑ [转化] |
|||||
|
溶解法 |
BaSO4(CaCO3)[加稀盐酸碳酸钙溶解,然后过滤];
[转化] Cu(CuO)[加酸或通足量CO加热]; Cu(Zn)[加酸或CuSO4溶液后过滤] |
|||||
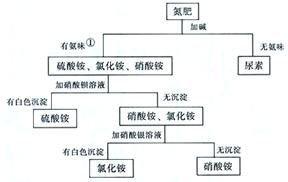
7.化肥的检验 |
 |
|||||
|
8.氢氧化钠的变质探究: 验证已经变质:加足量稀盐酸--有气泡冒出。 验证部分变质:加足量CaCl2溶液后,用石蕊(变蓝)或酚酞(变红)或pH试纸(pH大于7)。 除去变质生成的Na2CO3:溶解后,滴加Ca(OH)2溶液至无沉淀产生,然后过滤、蒸发。 |
||||||
|
植物缺乏氮肥:叶片发黄。缺乏磷肥:植株特别矮小。缺乏钾肥:易倒伏,叶片的边缘和尖端呈褐色 |
||||||
|
9.尾气处理装置:有CO生成或参加的反应如下: CO2与C--黑粉消失;CO与CuO--黑变红;CO与Fe2O3--红变黑。 尾气中CO的处理方法:用酒精灯点燃或用气球收集或用排水法收集。 |
||||||
|
10.电解水装置:通电后,电极上出现气泡,一段时间后试管1(O2)和试管2(H2)中所收集的气体体积比约为1∶2。 [负氢] [O2、H2的质量比为8∶1。] 结论:水由氢、氧两种元素组成;在化学反应中分子可分,原子不可分。 |
 |
|||||
|
11.净化水装置及多种方法: 自来水厂:取、沉淀、过滤、吸附、消毒、供 明矾:胶状物→小颗粒聚集→大颗粒沉降。 活性炭:有吸附性,起脱色去味作用。 蒸馏:净化程度最高。[蒸馏水可视为纯水] 上述净化水的方法中,只有蒸馏能使硬水软化。 |
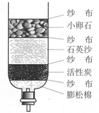 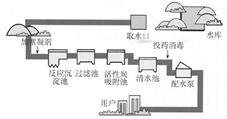 |
|||||
|
12.铁(铜)生锈实验、防锈方法: ⑴探究铁生锈条件:A:Fe、O2、H2O;B:Fe、H2O;C:Fe、O2。 防锈:洁净干燥、涂油、喷漆、镀其他金属、烤蓝、制成合金。[资源保护] ⑵铜生锈的条件:铜、氧气、水、二氧化碳四种物质共同作用。 如何探究铜生锈的条件?[可做七个对比实验][铁生锈做三个对比实验] |
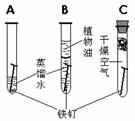 |
|||||
|
12.模拟炼铁:验纯后[防爆],通CO、加热[防爆],停止加热、继续通CO至冷却。[尾气处理] |
||||||
计算题
|
1.盛不同药品的装置的总质量的变化: 甲--无水硫酸铜或无水氯化钙--吸收H2O质量增加 甲--碱石灰--吸H2O或吸收CO2或同时吸收H2O和CO2增 乙--氧化铜或氧化铁--通过H2或CO后失去氧元素质量减少 乙--氧化铜和碳粉--释放CO2质量减少 丙--氢氧化钠溶液--吸收CO2质量增加 丙--浓硫酸--吸收H2O质量增加 |
   |
|
2.不同物质混合后总质量的变化:氢氧化钠溶液吸收CO2--质量增加、碳酸钙高温分解释放CO2--质量减小、铁合金遇酸以及黄铜(铜锌合金)遇酸释放H2--质量减小、石灰石或大理石或碳酸钠遇酸释放CO2--质量减小、过氧化氢与二氧化锰混合释放O2--质量减小 |
|
3.计算公式: 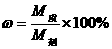 ; M质=M液×w; M=ρ×V; M质=ρ×V×w; M纯=M混×w。 ; M质=M液×w; M=ρ×V; M质=ρ×V×w; M纯=M混×w。 |
 2H2↑+O2↑表示。下列说法不正确的是( )
2H2↑+O2↑表示。下列说法不正确的是( )