网址:http://m.1010jiajiao.com/timu3_id_80921[举报]
![]()
已知常压下SO3体积分数为91%,试回答:?
(1)在生产中常用过量的空气是为了 。?
(2)加热到400~
(3)压强应采用(填“高压”或“常压”) ,原因是? 。?
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为 。?
(5)尾气中的SO2必须回收,是因为 。?
查看习题详情和答案>>(1)在生产中常用过量的空气是为了___________________。
(2)加热到400—500 ℃是由于___________。
(3)压强应采用__________ (填“高压”或“常压”)。原因是____________________________。
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为____________________。
(5)尾气中的SO2必须回收,是因为____________________。
查看习题详情和答案>>(1)在生产中常用过量的空气是为了______________________________________________。
(2)加热到400—
(3)压强应采用____________________(填“高压”或“常压”)。原因是___________________。
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为___________________________________。
(5)尾气中的SO2必须回收,是因为______________________________________________。
查看习题详情和答案>> 2SO3(g) △H <0。已知常压下SO3体积分数为91%,试回答:
2SO3(g) △H <0。已知常压下SO3体积分数为91%,试回答:(1)在生产中常用过量的空气是为了_____。
(2)加热到400℃~500℃是由于____。
(3)压强应采用____(填“高压”或“常压”)。原因是_____。
(4)常用质量分数为98. 3%的浓H2SO4来吸收SO3,而不是用水,是因为____。
(5)尾气中的SO2必须回收是因为____。
下列关于化工生产的叙述正确的是
A.炼钢就是在高炉中用还原剂把铁从铁矿石中还原出来
B.离子交换膜法制碱工业中,氢氧化钠在电解槽的阴极区产生
C.工业制硫酸中,三氧化硫是在吸收塔内用98%的硫酸吸收
D.黏土是生产陶瓷、玻璃和水泥的共同原料
(Ⅱ)氨是重要的无机化工产品之一,在国民经济中占有重要地位.世界上的氨除少量从焦炉气中回收副产外,绝大部分是合成的氨.海南岛的南海北部湾莺歌海海域有着丰富的天然气气田,利用此资源在东方市八所港建有一家大型的合成氨化肥厂.
(1)写出该化肥厂生产H2的化学反应方程式
(2)在硫酸的工业生产中,往往会增大O2的比例来提高SO2的转化率,在合成氨生产中是否会采用相同的方法,请说明理由.
(3)在制取原料气体的过程中,常混有一些杂质,在进入合成塔之前必须将杂质除去,原因是
(4)下图是氨的产率与温度的关系,曲线1表示平衡时氨的产率,曲线2表示反应进行一段时间但还未达到平衡时氨的含量.请分析A点氨的含量小于B的原因
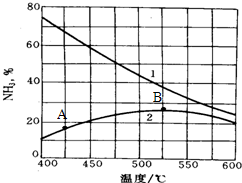
(5)在合成氨的生产过程中会产生大量CO2,该化肥厂与俄罗斯塔氏集团合作,利用这些CO2建设一个年产52万吨的小颗粒尿素加工厂,再进一步加工成氮磷钾复合肥,请写出该合成尿素反应的化学方程式