摘要:4.利用N2和H2可以实现NH3的工业合成.而氨又可以进一步制备硝酸.在工业上一般可进行连续生产.请回答下列问题: (1)已知:N2(g)+O2 △H=+180.5kJ/mol N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol 若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 . (2)某科研小组研究:在其他条件不变的情况下.改变起始物氧气的 物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响. 实验结果如图所示: (图中T表示温度.n表示物质的量) ①图像中T2和T1的关系是:T2 T2(填“高于 “低于 “等于 “无法确定 ) ②比较在a.b.c三点所处的平衡状态中.反应物N2的转化率最高的是 . ③在起始体系中加入N2的物质的量为 mol时.反应后氨的百分含量最大.若容器容积为H.n=3mol反应达到平衡时H2的转化率为60%.则此条件下(T2).反应的平衡常数K= . (3)N2O3是一种新型硝化剂.其性质和制备受到人们的关注. ①一定温度下.在恒容密闭容器中N2O3可发生下列反应: 2N2O3 4NO2(g) △H>0下表为反应在T1温度下的部分实验数据 Vs 0 500 1000 c(N2O3)/mol·L-1 5.00 3.52 2.48 ②现以H2.O2.熔融盐Na2CO3组成的燃料电池.采用电解法制备N2O3.装置如图所示.其中Y为CO2. 写出石墨I电极上发生反应的电极反应式 . 在电解池中生成N2O3的电极反应式为 .
网址:http://m.1010jiajiao.com/timu3_id_65920[举报]
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
226.3kJ
226.3kJ
.(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.
实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2
低于
低于
T1(填“高于”“低于”“等于”“无法确定”)②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
c
c
(填字母).(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
0.00592mol?L-1?s-1
0.00592mol?L-1?s-1
.能判断上述反应达到平衡的依据是
abd
abd
(填写序号)a.容器内压强保持不变 b.单位时间内每生成2mol NO2,同时生成1mol N2O5
c.容器内气体密度保持不变 d.NO2 与N2O5物质的量比例保持不变.
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
226.3kJ
226.3kJ
.(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.
实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2
低于
低于
T1(填“高于”“低于”“等于”“无法确定”).②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
c
c
(填字母).(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)=4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
0.00592mol?L-1?s-1
0.00592mol?L-1?s-1
. 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=
-905
-905
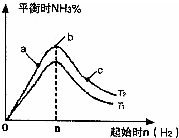
kJ/mol(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)?2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1
<
<
T2(填“高于”“低于”“等于”“无法确定”)②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是
c
c
(填字母).(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数.(写出计算过程,结果保留小数点后一位)
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
226.3kJ
226.3kJ
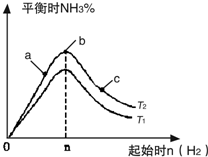
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)═2NH3(g)反应的影响.
实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2
低于
低于
T1(填“高于”、“低于”、“等于”或“无法确定”).②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
c
c
(填字母).③在起始体系中加入N2的物质的量为
| n |
| 3 |
| n |
| 3 |
2.08
2.08
.④若该反应在298K、398K时的平衡常数分别为K1,K2,则K1
>
>
K2(填“>”“=”“<”)⑤对于该反应有关表述正确的是
bd
bd
.a.其他条件不变,缩小容器体积时正反应速率增大,逆反应速率减小,故平衡将逆向移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.恒容条件下,若容器内气体的密度保持不变,则反应处于平衡状态
d.其他条件不变,将容器体积扩大为原来的2倍,则重新平衡时,NH3的平衡浓度将比原平衡浓度的一半还要小.
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
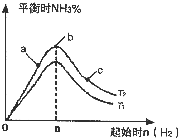
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)?2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算:(写出计算过程,结果保留小数点后一位)
①2min内以H2表示的化学反应速率;
②该条件下的平衡常数?