题目内容
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=
-905
-905
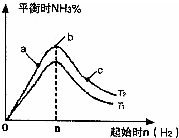
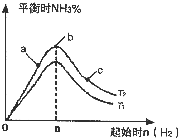
kJ/mol(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)?2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1
<
<
T2(填“高于”“低于”“等于”“无法确定”)②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是
c
c
(填字母).(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数.(写出计算过程,结果保留小数点后一位)
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①图象分析T1、T2,对应氨气的平衡含量,反应是放热反应,结合平衡移动原理分析判断;
②根据a、b、c三点所表示的意义来回答.
(2)①图象分析T1、T2,对应氨气的平衡含量,反应是放热反应,结合平衡移动原理分析判断;
②根据a、b、c三点所表示的意义来回答.
解答:解:(1)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
依据盖斯定律①×2+②×2-③×3得到①×2-②×2+③×3得到 4NH3(g)+5O2(g)=4NO(g)+6H2O△H=-905KJ/mol,故答案为:-905;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,
故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c.
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
依据盖斯定律①×2+②×2-③×3得到①×2-②×2+③×3得到 4NH3(g)+5O2(g)=4NO(g)+6H2O△H=-905KJ/mol,故答案为:-905;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,
故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c.
点评:本题考查了图象分析,热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析,图象判断是关键,题目难度中等.

练习册系列答案
相关题目
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: