题目内容
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
226.3kJ
226.3kJ
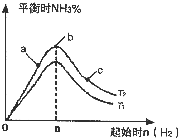
.(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.
实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2
低于
低于
T1(填“高于”“低于”“等于”“无法确定”)②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
c
c
(填字母).(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
0.00592mol?L-1?s-1
0.00592mol?L-1?s-1
.能判断上述反应达到平衡的依据是
abd
abd
(填写序号)a.容器内压强保持不变 b.单位时间内每生成2mol NO2,同时生成1mol N2O5
c.容器内气体密度保持不变 d.NO2 与N2O5物质的量比例保持不变.
分析:(1)根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比;
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
(3)500s,c(N2O5)变化量为5.00-3.52=1.48mol/L,结合v=
计算;利用平衡的特征“等”、“定”及由此衍生的物理量来判断平衡.
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
(3)500s,c(N2O5)变化量为5.00-3.52=1.48mol/L,结合v=
| △c |
| △t |
解答:解:(1)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.2kJ/mol;
则17g 即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
×905.2kJ=226.3kJ,
故答案为:226.3kJ;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
(3)500s,c(N2O5)变化量为5.00-3.52=1.48mol/L,则v(N2O5)=
=
=0.00296mol?L-1?s-1,由速率之比等于化学计量数之比可知,v(NO2)=0.00296mol?L-1?s-1×2=0.00592 mol?L-1?s-1;
a.该反应为体积不等的反应,则容器内压强保持不变,达到平衡,故选;
b.单位时间内每生成2mol NO2,同时生成1mol N2O5,正逆反应速率相等,达到平衡,故选;
c.恒容密闭容器,气体质量不变,容器内气体密度始终保持不变,不能判定平衡状态,故不选;
d.NO2与N2O5物质的量比例保持不变,物质的量不再变化,达到平衡,故选;
故答案为:0.00592 mol?L-1?s-1;abd.
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.2kJ/mol;
则17g 即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
| 1 |
| 4 |
故答案为:226.3kJ;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
(3)500s,c(N2O5)变化量为5.00-3.52=1.48mol/L,则v(N2O5)=
| △c |
| △t |
| 1.48mol/L |
| 500s |
a.该反应为体积不等的反应,则容器内压强保持不变,达到平衡,故选;
b.单位时间内每生成2mol NO2,同时生成1mol N2O5,正逆反应速率相等,达到平衡,故选;
c.恒容密闭容器,气体质量不变,容器内气体密度始终保持不变,不能判定平衡状态,故不选;
d.NO2与N2O5物质的量比例保持不变,物质的量不再变化,达到平衡,故选;
故答案为:0.00592 mol?L-1?s-1;abd.
点评:本题考查了盖斯定律、外界条件对反应速率和平衡的影响、平衡的判断等,题目难度中等,注重高考常考点的考查,注意图象和表格中数据的分析.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: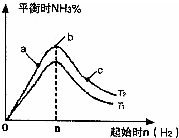 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: