题目内容
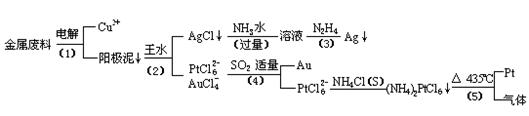
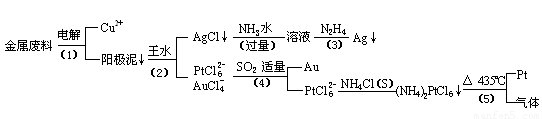
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下: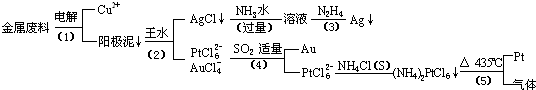
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电极反应式:阳极:
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
分析:(1)依据金属精炼的原理分析判断,含银、铜、金和铂的金属废料,含金、银、铂的非金属做电解池的阳极,活泼金属铜失电子形成金属离子进入溶液,铜离子在阴极得到电子生成Cu,不活泼金属形成阳极泥进行工业分离;根据生成的Cu与转移电子的关系求算;
(2)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金;
(3)依据王水组成,结合平衡移动方向分析判断;
(2)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金;
(3)依据王水组成,结合平衡移动方向分析判断;
解答:解:(1)金属废料中含银、铜、金和铂,利用电解原理分类应用,结合金属精炼原理分析可知,金属废料做电解池阳极,其中铜失电子发生氧化反应:Cu-2e-=Cu2+;铜离子在阴极得到电子生成Cu,Cu2++2e-=Cu,工作一段时间后测得导线上通过了3.01×1024个e-,则电子的物质的量为5mol,
根据Cu2++2e-=Cu可知,转移5mol电子生成2.5molCu,所以生成Cu的质量为2.5mol×64g/mol=160g;
故答案为:Cu-2e-=Cu2+;Cu2++2e-=Cu;160;
(2)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;
(3)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;
故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水;
根据Cu2++2e-=Cu可知,转移5mol电子生成2.5molCu,所以生成Cu的质量为2.5mol×64g/mol=160g;
故答案为:Cu-2e-=Cu2+;Cu2++2e-=Cu;160;
(2)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;
(3)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;
故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水;
点评:本题考查了金属精炼原理的应用,银氨溶液和含醛基的反应离子方程式的书写,氧化还原反应的分析判断,平衡移动的影响因素分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O