题目内容
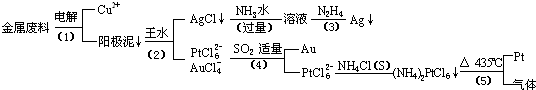
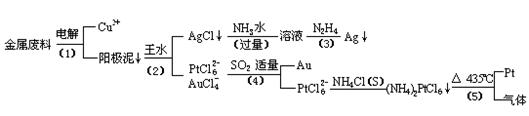
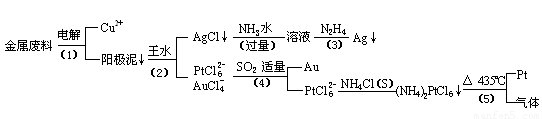
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:

根据以上工艺回答下列问题:
(1)电解时,以
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
(3)写出步骤(4)的离子反应方程式:
(4)王水是
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:

根据以上工艺回答下列问题:
(1)电解时,以
金属废料
金属废料
为阳极,纯铜为阴极,CuSO4溶液为电解液,则阳极的电极反应式为:Cu-2e-→Cu2+
Cu-2e-→Cu2+
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
; 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O(3)写出步骤(4)的离子反应方程式:
2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
;(4)王水是
浓盐酸和浓硝酸
浓盐酸和浓硝酸
的混合液,其体积比为:3:1
3:1
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水
王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水
.分析:(1)依据金属精炼的原理分析判断,含银、铜、金和铂的金属废料,含金、银、铂的非金属做电解池的阳极,活泼金属铜失电子形成金属离子进入溶液,不活泼金属形成阳极泥进行工业分离;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子为银氨络离子,在碱性条件下,用葡萄糖将其还原为银,实质是葡萄糖中的醛基被氧化发生银镜反应;
(3)银镜流程变化故选结合反应物和生成物的离子和物质,分析化合价变化,银镜氧化还原反应的电子守恒计算分析书写;
(4)根据王水的组成分析判断;
(5)依据王水组成,结合平衡移动方向分析判断;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子为银氨络离子,在碱性条件下,用葡萄糖将其还原为银,实质是葡萄糖中的醛基被氧化发生银镜反应;
(3)银镜流程变化故选结合反应物和生成物的离子和物质,分析化合价变化,银镜氧化还原反应的电子守恒计算分析书写;
(4)根据王水的组成分析判断;
(5)依据王水组成,结合平衡移动方向分析判断;
解答:解:(1)金属废料中含银、铜、金和铂,利用电解原理分类应用,结合金属精炼原理分析可知,金属废料做电解池阳极,其中铜失电子发生氧化反应,金、银、铂
作为阳极泥沉降在电解池底部,提取金、银、铂进行工业提取,故答案为:金属废料; Cu-2e-→Cu2+;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子为银氨络离子,在碱性条件下,用葡萄糖将其还原为银,实质是葡萄糖中的醛基被氧化发生银镜反应;反应的离子方程式为:
2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O;故答案为:2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O;
(3)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;
(4)王水的组成是浓盐酸和浓硝酸按照3:1混合组成的混合物;故答案为:浓盐酸和浓硝酸;3:1;
(5)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水;
作为阳极泥沉降在电解池底部,提取金、银、铂进行工业提取,故答案为:金属废料; Cu-2e-→Cu2+;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子为银氨络离子,在碱性条件下,用葡萄糖将其还原为银,实质是葡萄糖中的醛基被氧化发生银镜反应;反应的离子方程式为:
2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO
| 加热 |
| 加热 |
(3)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;
(4)王水的组成是浓盐酸和浓硝酸按照3:1混合组成的混合物;故答案为:浓盐酸和浓硝酸;3:1;
(5)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水;
点评:本题考查了金属精炼原理的应用,银氨溶液和含醛基的反应离子方程式的书写,氧化还原反应的分析判断,平衡移动的影响因素分析,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目