题目内容
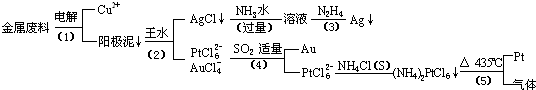
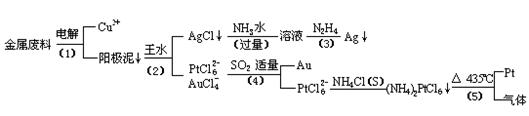
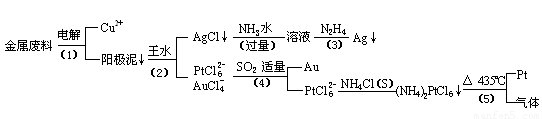
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
根据以上工艺回答下列问题:
(1) 电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:
阴极: ;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
;
(3)写出步骤(4)的离子反应方程式:
;
(4)金和浓硝酸反应的化学方程式为:
Au + 6HNO3(浓)= Au(NO3)3 +3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
(1)、
(各1分)
(2)2Ag(NH3)2++ 2OH— + CH2OH(CHOH)4CHO → 2Ag + 4NH3+ CH2OH(CHOH)4COOH + H2O(3分)
(3)2AuCl4- + 3SO2 + 6 H2O = 2Au + 8Cl- + 3SO42-+ 12H+ (3分)
(4)王水中含有大量的Cl—,Au3+与Cl—可生成AuCl4—,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水。(3分)
解析:略


 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O