摘要:从含银.铜.金和铂的金属废料中提取金.银.铂的一种工艺如下: 根据以上工艺回答下列问题: (1) 电解时.以金属废料为阳极.纯铜为阴极.CuSO4溶液为电解液. 写出电解方程式: 阳极: 阴极: , (2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下.也可用葡萄糖将其还原为银.写出该反应的离子方程式: , 的离子反应方程式: , (4)金和浓硝酸反应的化学方程式为: Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O 但该反应的平衡常数很小.所以金和浓硝酸几乎不反应.但金却可以溶于王水.试简要解释之: . 21 .⑴肼(N2H4)又称联氨.是一种可燃性的液体.可用作火箭燃料.已知在101kPa时.32.0gN2H4在氧气中完全燃烧生成氮气.放出热量624kJ.N2H4完全燃烧反应的热化学方程式是 . ⑵肼-空气燃料电池是一种碱性燃料电池.电解质溶液是20%-30%的KOH溶液.肼-空气燃料电池放电时:正极的电极反应式是 . 负极的电极反应式是 . ⑶右图是一个电化学过程示意图. ① 锌片上发生的电极反应是 . ②假设使用肼-空气燃料电池作为本过程中的电源.铜片的质量变化128g.则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%) ⑷传统制备肼的方法.是以NaClO氧化NH3.制得肼的稀溶液.该反应的离子方程式 南昌市铁路一中2010-2011学年度高三12月月考 化学试卷
网址:http://m.1010jiajiao.com/timu3_id_429763[举报]
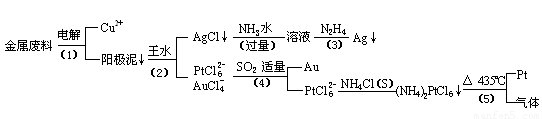
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:

根据以上工艺回答下列问题:
(1)电解时,以
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
(3)写出步骤(4)的离子反应方程式:
(4)王水是
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
查看习题详情和答案>>

根据以上工艺回答下列问题:
(1)电解时,以
金属废料
金属废料
为阳极,纯铜为阴极,CuSO4溶液为电解液,则阳极的电极反应式为:Cu-2e-→Cu2+
Cu-2e-→Cu2+
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
; 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O(3)写出步骤(4)的离子反应方程式:
2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
;(4)王水是
浓盐酸和浓硝酸
浓盐酸和浓硝酸
的混合液,其体积比为:3:1
3:1
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水
王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水
.
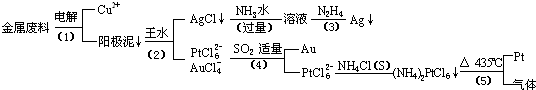
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电极反应式:阳极: ,阴极: ;
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有 g铜析出.
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式: ;
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之: .
查看习题详情和答案>>

根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电极反应式:阳极:
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
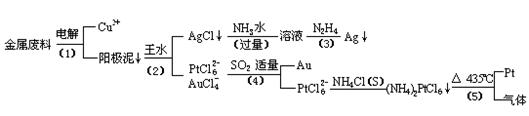
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
根据以上工艺回答下列问题:
电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:
阴极: ;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
;
(3)写出步骤(4)的离子反应方程式:
;
(4)金和浓硝酸反应的化学方程式为:
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
查看习题详情和答案>>