摘要:基本训练1:判断下列说法是否正确. ①气体摩尔体积单位是L. ②任何条件下.气体摩尔体积均是22.4L/mol ③标准状况下.1mol H2O的体积约为22.4L.④1molCO2的体积是22.4L. ⑤20℃.101kPa下.1mol H2的体积是22.4L. ⑥只有在标准状况下.气体摩尔体积才是22.4L/mol. ⑦标准状况下.0.5molH2 和0.5molO2 的体积是22.4L. ⑧ 22.4L气体所含分子数一定大于11.2L气体所含的分子数. 基本训练2:关于气体摩尔体积的计算.
网址:http://m.1010jiajiao.com/timu3_id_191994[举报]
 (1)判断下列说法,正确的是
(1)判断下列说法,正确的是④
④
.含元素种类相同而结构不同的化合物互为同分异构体;
②某有机物完全燃烧后生成二氧化碳和水,说明该有机物中必定含有碳、氢、氧3种元素;
③甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷和氯化氢;
④乙烯与氯气加成反应的产物是

(2)乙醇分子中不同的化学键如图所示.在不同反应中断键位置不同.
请用代号填写下列空白①与金属钠反应:
①
①
化学方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
②在铜催化下与O2反应:①和④
①和④
化学方程式:2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| Cu |
| △ |
(2012?唐山三模)(1)常温下,浓度均为0.1mol/L的6种溶液的pH如下表:
①上述溶液中的阴离子结合H+能力最弱的为
②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
①判断下列说法正确的是
A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
查看习题详情和答案>>
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5Na |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
CH3COO-
CH3COO-
,d溶液呈碱性的原因是ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示).②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
BE
BE
.A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
.④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
10n-12
10n-12
mol/L.(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
K=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
K=
.| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
| 物质 | CH3OH | CHO3CH3 | H2O |
| 浓度/mol/L | 0.8 | 1.24 | 1.24 |
D
D
(填字母代号).A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
31
31
kJ.已知25℃、101kPa下,石墨和金刚石燃烧的热化学方程式:
C(石墨)+O2(g)=CO2(g)△H=-393.51kJ?molˉ1
C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ?molˉ1
据此判断下列说法正确的是( )
C(石墨)+O2(g)=CO2(g)△H=-393.51kJ?molˉ1
C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ?molˉ1
据此判断下列说法正确的是( )
| A、石墨比金刚石稳定 | B、金刚石比石墨稳定 | C、燃烧等质量时石墨的放出能量比金刚石高 | D、燃烧等质量时石墨的放出能量与金刚石一样多 |
在25℃、101kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ?mol-1
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ?mol-1
由此判断下列说法正确的是( )
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ?mol-1
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ?mol-1
由此判断下列说法正确的是( )
查看习题详情和答案>>
已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示:
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是 (填“序号”).
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示).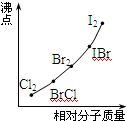
(3)部分XX′型卤素互化物(X、X′表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如图所示的关系.试推测ICl的沸点所处的最小范围 (填“物质的化学式”).
查看习题详情和答案>>
| ① | He:-268.8 | Ne:-246 | Ar:-185.7 | Kr:-153.3 |
| ② | F2:-188.1 | Cl2:-34.6 | Br2:+58.8 | I2:+184 |
| ③ | NH3:-33 | PH3:-83 | AsH3:-55 | SbH3:-18.8 |
| ④ | H2O:+100 | H2S:-61 | H2Se:-41 | H2Te:-2 |
| ⑤ | HF:+20 | HCl:-85 | HBr:-67 | HI:-36 |
(1)判断下列说法不正确的是
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种):

(3)部分XX′型卤素互化物(X、X′表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如图所示的关系.试推测ICl的沸点所处的最小范围