2009年辽宁中考综合复习训练化学试题(三)
理化考试时间l50分钟 化学试卷满分65分
可用到的相对原子质量:H―l C―12 N一14 O―16 Na―
一、选择题(本题包括重3道小题,l―11小题每小题1分;l2、13小题每小题2分;共15分。每小题有一个最符合题目要求的选项,请选出后将其序号填在题后的括号内)
1.人类使用材料的历史,就是人类利用物质的进步史。制造下列用品所需的材料不是通过化学变化获取的是 ( )
A.木器 B.青铜器 C.铁器 D.塑料器具
2.为减少实验室里的污染,同学们提出了以下几种观点,其中合理的是 ( )
①尽可能减少药品的用量,推广做微型实验
②将实验后的气体净化再排放
③有污染的实验一定不要做
④有气体污染的实验.做完后立即封闭实验室,以防污染室外空气
A.①②④ B.②③④ C.①② D.②④
3.北京奥运火炬所用燃料是丙烷(C3H8),下列有关丙烷的说法不正确的是 ( )
A.从组成上看:丙烷由碳、氢两种元素组成
B.从分子结构上看:一个丙烷分子由3个碳原子、8个氢原子构成
C.从性质上看:丙烷具有可燃性
D.从变化上看:丙烷完全燃烧只生成水
4.某元素的原子结构示意图为 ,下列关于该元素的说法错误的是 ( )
,下列关于该元素的说法错误的是 ( )
A.它的阳离子带1个单位正电荷
B.它的阳离子有10个质子
C.它是一种金属元素
D.它的原子核外有11个电子
5.下列各组化学符号中,属于不同元素的是 ( )
A.Cl和Cl B.Fe2+和Fe3+
B.Fe2+和Fe3+
C. D.
D.
6.下列实验现象和对应的结论论述都正确的是 ( )
A.在某固体中滴加稀盐酸,有气泡产生――该固体一定是碳酸盐
B.向某黑色固体滴入一种无色溶液,有气泡产生――该气体一定是氧气
C.生石灰块投入水中,水会沸腾――生石灰变成熟石灰的过程是放热反应
D.向饱和硫酸铵溶液中加入鸡蛋清,产生白色絮状沉淀――蛋白质变性
7.下列做法中,能减缓化学反应速率的是
A.面团发酵时,放在温热处
B.人在进食时,细细咀嚼食物
C.在食品密封包装时,填充氮气
D.煤燃烧时,向煤炉内鼓入空气
8.在确定某无色溶液溶质成分的探究实验中,得知该溶液中含有三种溶质。下面是四位同学分别得到的四组结论,其中正确的一组是 ( )
A.该溶液中的溶质:HCl、K2SO4、NaOH
B.该溶液中的溶质:Na2SO4、MgCl2、NaOH
C.该溶液中的溶质:CuSO4、HCl、Mg(NO3)2
D.该溶液中的溶质:Na2CO3、NaCl、NaOH
9.贝壳(含CaCO3)煅烧后得CaO,CaO加到海水(含有MgCl2)池中得Mg(OH)2沉淀,Mg(OH)2与盐酸反应得MgCl2溶液,上述生产过程中没有涉及的反应类型是 ( )
A.化合反应 B.置换反应 C.复分解反应 D.分解反应
10.为测定H2SO4与NaOH发生中和反应时放出的热量,在下图的小烧杯中装入一定量的NaOH,测其温度;另取一定量的硫酸,测其温度,并缓慢地倾入小烧杯中,边加边用环形玻璃搅拌棒搅拌。记录溶液温度的变化。甲、乙、丙、丁四位同学准备选择以下试剂进行实验,其中合理的一组试剂是 ( )
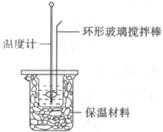
选项
同学
使用的NaOH
使用的H2SO4
A
甲
NaOH固体
稀H2SO4
B
乙
NaOH溶液
浓H2SO4
C
丙
NaOH溶液
稀H2SO4
D
丁
NaOH固体
浓H2SO4
11.科学合理地使用燃料,可有效防止环境污染。下列说法错误的是 ( )
A.在汽油中加入适量乙醇可减少汽车尾气的污染
B.把煤加工成蜂窝煤可使煤燃烧更加充分
C.煤气是一种经济方便、清洁卫生、燃烧效率很高的燃料
D.石油通过化学变化后得到汽油、煤油、柴油等一系列产品
12.下列做法正确的是 ( )
A.将硬水转化为软水,可以用过滤的方法
B.除去氢氧化钠溶液中少量氢氧化钙,可以先加入过量的碳酸钠溶液,然后过滤
C.除去生石灰中少量碳酸钙,可以加足量水后,过滤
D.除去铜粉中少量氧化铜粉末,可以加足量的稀硫酸后,过滤
13.某课外兴趣小组的同学绘制了下面几种实验操作的变化趋势图象,其中不正确的是 ( )
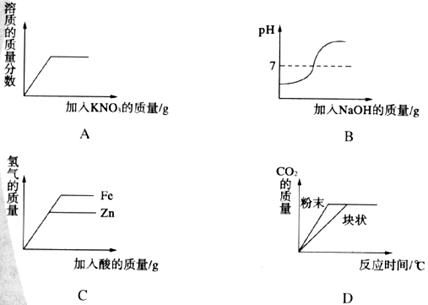
A.向接近饱和的硝酸钾溶液中加足量的硝酸钾固体
B.向稀盐酸中滴入足量的氢氧化钠溶液
C.向等质量的金属铁和锌中分别滴入足量的相同质量分数的稀硫酸
D.向等质量的碳酸钙中分别滴入足量的等体积、等质量分数的稀盐酸
二、填空题(本题包括4道小题,每空1分,共14分)
14.科学家在合成超导材料时,偶然制得了自然界中尚未发现的紫色化学合成物质BaCuSi2O6,则它由_________种化学元素组成。如果其中铜的化合价为+2价,则按照一般规律其中Si元素应显示______价,写出相同价态的Si元素的氧化物地化学式为__________。
15.某化肥包装袋上的部分说明如图所示。

(1)硝酸铵属化学肥料中的__________(填序号);
A.钾肥 B.氮肥 C.磷肥
(2)硝酸铵应具有的性质是__________(填序号);
A.易溶于水 B.有挥发性 C.受热易分解
(3)硝酸铵能与强碱反应,其中与碱反应的方程式为:
NH4NO3+NaOH==NaNO3+NH3↑+X,
则X的化学式是:_________________;施用该类肥料时,要避免与_______(填“酸”或“碱”)性物质混用,否则会降低肥效。
16.在阳光明媚的假日,去郊游野炊实为一大快事,然而,在野炊的过程中,如果遇到下面一些问题,你将如何处理?
(1)野炊用的餐具,最好是导热性好、不易破碎的材料制的,你准备带的餐具是用_______制的;
A.金属 B.陶瓷 C.无所谓
(2)在“灶”上悬挂野炊锅时,应调节野炊锅到合适的高度,其原因可能是: ______;
(3)野餐食谱如下:主食:馒头;配菜:烤火腿、鲫鱼汤、五香豆干。
主食和配菜中主要含蛋白质、______、油脂、无机盐和水等营养素,从营养角度来看,你准备再添一样__________; (填字母)
A.炒鸡蛋 B.牛奶 C.黄瓜 D.烤野兔肉
(4)在引燃细枯枝后,如果迅速往“灶”里塞满枯枝,结果反而燃烧不旺,并产生很多浓烟,说明物质充分燃烧需要的条件是_________________________________;
(5)若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),下列物质可用于涂抹以减轻疼痛的是_________。
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
17.小涵用在空气中燃烧镁带的实验来探究质量守恒定律。当镁带完全燃烧后,称量留下固体的质量比反应前镁带质量还轻,联系实验过程分析,其原因可能是________________。
三、简答题(本题包括5道小题,共22分)
18.(3分)写出下列错误操作可能造成的后果:
(1)加热高锰酸钾制氧气,试管口没放棉花___________________________;
(2)使用氢氧化钠溶液后,忘记盖胶塞___________________________;
(3)用pH试纸测定稀盐酸时,先将试纸用水润湿,测得的结果_________(填“偏大”、“偏小”或“不变”)。
19.(2分)一帆同学在总结实验室有些药品需密封保存的原因时,归纳了下列两种情况:
①药品能吸收空气中的水蒸气;②药品能与空气中的某些成分发生化学反应。
(1)写出一个符合情况②的化学方程式:_______________________________;
(2)一帆同学的归纳不完整。你还能补充的一种情况是__________________________。
20.(5分)2008年9月,石家庄市三鹿牌婴儿奶粉被查出奶粉中含有对人体有害的物质――三聚氰胺。
【查阅资料1】三聚氰胺的化学式为C3H6N6,又称密胺或蛋白精。它是一种白色固体,无气味无味道,微溶于水,溶于热水。低毒,动物长期摄入会造成生殖、泌尿系统损坏,膀胱肾部结石,并可进一步诱发膀胱癌。三聚氰胺是工业上制造装饰板――三聚氰胺甲酸树酯的原料。
【查阅资料2】牛奶中主要营养成分是蛋白质,而蛋白质中都含氮元素。由于牛奶中蛋白质的检测太不容易,所以牛奶检测常用的方法是“凯氏定氮法”,也就是测出牛奶中氮元素的含量来推测出蛋白质的含量。如果牛奶中氮的含量太低,说明牛奶中掺水太多。
根据上述信息回答:
(1)三聚氰胺属于____________(填“有机物”或“无机物”);
(2)三聚氰胺中氮元素的质量分数为_______________________;
(3)国家牛奶检测标准是:合格生鲜牛奶
(4)不法分子向不合格的生鲜牛奶中加入三聚氰胺的目的是___________来通过检测标准,获取非法利益:
(5)掺入少量三聚氰胺后的牛奶,不易被人们发现的可能原因是__________________。
21.(7分)2008年“中国水周”活动的宣传主题为“发展水利 改善民生”。
(1)保持水的化学性质的最小粒子是____________;
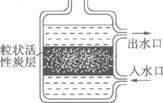
(2)下图是活性炭净水器示意图,其中活性炭的作用是:不仅可以__________的物质,还可以_____________的杂质;
(3)有一杯主要含有MgCl2和CaCl2的硬水。某兴趣小组设计出软化水的部分实验方案,请你一起完成。
可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水。
实验步骤
现象
结论或化学方程式
①取少量水样于试管中,向其中滴加
Ca(OH)2溶液,直到不再产生沉淀
有白色
沉淀产生
MgCl2+Ca(OH)2==Mg(OH)2↓+CaCl2
②继续向上述试管中滴加________,直到不再产生沉淀
有白色
沉淀产生
化学方程式:_________________
③过滤
滤液澄清
④___________________
__________
证明硬水已软化
22.(5分)学校实验室有一瓶废液,其中含硫酸铜和硫酸锌两种溶质。小鹤和小琪同学利用所学知识欲制取金属铜,并回收硫酸锌固体。设计了以下方案:
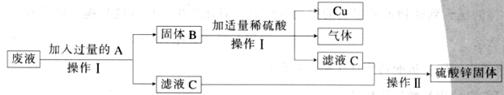
(1)操作Ⅰ、Ⅱ的名称分别是____________________、_______________________;
(2)加入过量A目的是_________________________________,其反应的化学方程式是_______________________________________;
(3)实验中加入适量稀硫酸,这里的“适量”,看到的现象是________________________。
四.探究题(本题包括2道小题,共8分)
23.(3分)唯民同学在实验室帮助老师准备实验的时候,看到一试剂瓶(如图所示)。于是他猜想:乙醇含有“氢氧根”,所以它的水溶液应该显碱性。在老师的鼓励下,唯民同学通过实验,发现了自己的猜想是错误的。请你帮他填写下面的实验报告。

实验步骤
观察到的现象
结 论
乙醇溶液不显碱性
24.(5分)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛。小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示。

为了验证该药物的主要成分是碳酸盐,他进行了如下实验:首先将药片放入试管中,向其中加入适量的稀盐酸,然后_______________________________(写实验操作和实验现象)。
当楠溪看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和她一起完成探究活动。
【提出问题】抗酸药为什么嚼碎后服用?
【作出猜想】她的猜想是_____________________________。
【设计实验】实验一:将一片完整的药片放入试管中,向其中加入5mL5%的稀盐酸;
实验二:将______________放入试管中,向其中加入5ml 5%的稀盐酸。
【现象与结论】实验二比实验一反映快。证明楠溪的猜想正确。
【拓展探究】(1)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药。这些物质必须具备两个条件:一是能与胃酸作用;二是_____________________;
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是________________________。
五、计算题(本题包括2道小题,共6分)
25.(2分)下图是化学实验实中浓硫酸试剂瓶上标签的部分内容,请根据标签回答下列问题:

(1)实验室需配制19.6%的稀硫酸
(2)浓硫酸要密封保存的原因是__________________。
26.(4分)某环保小组监测到一工厂向河中排放的酸性废液中含有CuCl2。为了测定废液中CuCl2的质量分数,该小组取了
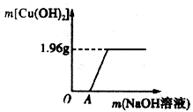
(1)计算废液中CuCl2的质量分数;
(2)说明图上OA段未生成Cu(OH)2沉淀的原因。