前黄高级中学高一化学综合测试题
( 满分:120分 时间:100分钟)
可能用到的相对原子质量:H:
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括12小题,每小题只有一个正确选项,每小题3分,共36分)
1.电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中……假如潘冬子在实验室中,欲从食盐水中提取出食盐,最好采用的方法是 ( )
A.过滤 B.萃取 C.蒸发 D.蒸馏
2.在地球上,一切生命活动都是起源于水的,下列有关水的物理量中,不随取水的体积变化而变化的是 ( )
A.水的物质的量 B.水的摩尔质量
C.水的质量 D.水被电解时所产生的氢气的质量
3.科学家在
A、溶液 B、悬浊液 C、乳浊液 D、胶体
4.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 ( )
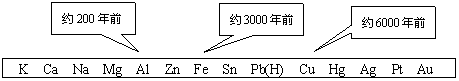
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
5.莫尔盐是硫酸亚铁铵,其化学式为(NH4)2Fe(SO4)2?6H2O,常用作氧化还原反应中作滴定用的基准物质。下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2?6H2O晶体后,仍能大量共存的是 ( )
A.Mg2+ Fe3+ SCN- Cl- B.Na+ Mg2+ Cl- SO42-
C.Na+ H+ Cl- NO3- D.K+ Ba2+ OH- I-
6.下列反应,其产物按红、红褐、淡黄的顺序排列的是 ( )
①金属钠在纯氧气中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液
A.③②① B.②③① C.③①② D.①②③
7.下图分别表示四种操作,其中有两个错误的是 ( )

A B C D
8.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.78gNa2O2固体中含有6.02×1023个O ? 离子
B.标准状况下,
C.
D.物质的量相等的Na2O和Na2O2晶体,所含有离子个数相同
9.某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清只含硝酸钠而排放,污染程度会大大降低。关于污染源的分析,你认为正确的是 ( )
A、Na+ 和NO3- 来自同一工厂 B、Cl- 和NO3- 一定在同一工厂
C、SO42- 和OH- 可能来自同一工厂 D、Ag+ 和Na+ 可能在同一工厂
10.下列各组物质在溶液中的反应,可用同一离子方程式表示的是 ( )
A、Cu(OH)2 和 盐酸 ; Cu(OH)2 和CH3COOH
B、BaCl2 和 Na2SO4 ; Ba(OH)2 和 (NH4)2SO4
C、NaHCO3 和 NaHSO4 ;Na2CO3 和 NaHSO4
D、NaHCO3(过量)和 Ca(OH)2 ; Ca(HCO3)2 和 NaOH(过量)
 11.如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比
( )
11.如图所示,在一只盛有Ba(OH)2溶液的烧杯中,漂浮着一个小木块,若小心地向烧杯中滴加与 Ba(OH)2溶液密度相同的稀硫酸,静止片刻后,小木块浸入液体中的体积与原先相比
( )
A.增大 B.不变 C.减小 D.无法判断
12.在甲、乙、丙、丁四个烧杯中分别放入1mol的钠、氧化钠、过氧化钠、氢氧化钠,然后各加入1000mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数由大到小的顺序是( )
A.甲<乙<丙<丁 B.丁<甲<乙=丙 C.甲=丁<乙=丙 D.丁<甲<乙<丙
二、选择题(本题包括6小题,每小题有一到两个答案符合题意,每小题4分共24分)
13. 将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是 ( )

A B C D
14.下列离子方程式书写正确的是 ( )
A.碳酸氢钠溶液与少量澄清石灰水反应:2HCO3-+Ca2+ +2OH-=CaCO3 ↓+2H2O+CO32-
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铁粉: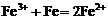
D.过量的NaHSO4和Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
15.有一块Al-Fe合金、溶于足量的盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼热,完全变成红色粉末,经称量红色粉末和合金质量恰好相等,则合金中铝的质量分数为 ( )
A.70% B.52.4% C.30% D. 47.6%
16.将
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中加入无色KSCN溶液,显红色
C.Fe2+和Fe3+的物质的量之比为6∶1
D.氧化产物和还原产物的物质的量之比为2∶5
17.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 ( )
A.②⑤④①③ B.④①②⑤③ C.①④②⑤③ D.⑤②④①③
18.
A.5.8 B.
Ⅱ卷(非选择题,共60分)
三、填空题
19.(9分)下列物质能导电的有 ;是电解质的有 ;属于非电解质的是 。
A、NaCl 固体 B、蔗糖溶液 C、NaCl溶液 D、酒精溶液 E、NaOH溶液
F、稀硫酸 G、铜 H、氨水 I、SO3 J、氨气 K、BaSO4
20.(7分)用一种试剂鉴别MgSO4、Al2(SO4)3、Fe2(SO4)3三种失去标签的稀溶液,这种试剂是___________(填化学式),写出鉴别的主要现象和反应的离子方程式:
实验现象
离子方程式
⑴MgSO4
⑵Al2(SO4)3
⑶Fe2(SO4)3
21. (6分)(1)黑火药爆炸时发生的反应为S+2KNO3+3C=K2S+N2↑+3CO2↑,反应中氧化剂为 ;
(2)反应2H2S+SO2=3S+2H2O中,当有1 mol 还原剂被氧化时,转移电子是 mol。
(3)若分别用KMnO4、KClO3、H2O2分解来制取等物质的量的O2,则反应中,转移电子数之比为 。
22.(6分)可能含有下列离子:K+、H+、Mg2+、OH-、CO 、Cl-的某无色透明溶液,能与Al反应放出H2.
、Cl-的某无色透明溶液,能与Al反应放出H2.
①若反应时Al转变成Al3+并放出H2,则该溶液中一定有 离子,一定无大量 离子 ,可能有 离子.
②若与Al反应后,向所得溶液中滴加盐酸,发现仅有白色沉淀生成,则该无色溶液中,一定有 离子,一定无大量 离子,可能存在的离子有 .
23、(6分)下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)
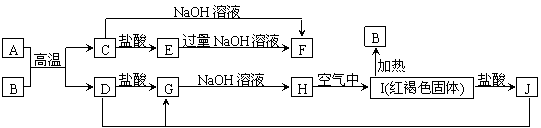

请回答以下问题:
(1)B是__________,H是_______________。(填化学式)
(2)写出A与B反应的化学方程式_________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的离子方程式 _______。
 四、实验题:(8分)
四、实验题:(8分)
24.下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 ,A中反应的离子方程式为___________________。
(2)实验开始时应先将活塞E_______(填“打开”或“关闭”),目的 ;在C中收到的气体主要为______。
(3)简述生成Fe(OH)2的操作过程________________________________;
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
______________________________________________________________。
 四、计算题(两小题,共18分)
四、计算题(两小题,共18分)
 26.(12分)将一定量的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。若在滴加NaOH溶液的过程中,产生的沉淀质量m随加入NaOH溶液的体积V变化如下图所示,请回答:
26.(12分)将一定量的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。若在滴加NaOH溶液的过程中,产生的沉淀质量m随加入NaOH溶液的体积V变化如下图所示,请回答:
(1) 若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
(2) V2等于440mL时,沉淀的质量m等于3.48g,求n(Mg)= mol,
n(Al)= mol。
(3) V1的值是 mL。
前黄高级中学高一化学综合测试题答卷纸
19. , ,
20 .
实验现象
离子方程式
⑴MgSO4
⑵Al2(SO4)3
⑶Fe2(SO4)3
21. (1) (2) (3)
22.⑴ , ,
(2) , ,
23. (1)
(2)
(3)
24.(1) ;
(2) ; ;
(3)
(4)
四、计算题
25.(1) (2)
26. (1) ,(2) , 。(3)
前黄高级中学高一化学综合测试题答案
1
2
3
4
5
6
7
8
9
10
C
B
D
D
B
A
B
D
C
D
11
12
13
14
15
16
17
18
A
B
D
AD
C
BC
AD
C
三、填空题
19. C E F G H, A K,IJ
20 .NaOH
实验现象
离子方程式
白色沉淀
Mg2*+2OH- = Mg(OH)2↓
先产生白色沉淀,后沉淀消失
Al3*+3OH-= Al(OH)3↓
Al(OH)3 + OH- = AlO2 -+ 2H2O
红褐色沉淀
Fe3* + 3OH- =Fe(OH)3↓
21. (1)S、KNO3
(2)2
(3)2:2:1
22.⑴H+、Cl-, OH-、CO32-, K+、Mg2+ (2) OH-、K+, Mg2+、H+、CO32-,Cl-
23. (1)Fe2O3 Fe(OH)2 (2)2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑
24. (1)铁屑;Fe+2H+=Fe2++H2↑
(2)打开;排出装置中的空气;氢气(H2)
(3)关闭活塞E,使A中液体被气体压入B中,生成Fe(OH)2沉淀
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
四、计算题
25.(1)2×10-4 (2)1.2×10-4
26. (1)400,(2)0.06, 0.04。(3)160