摘要: 0.06. 0.04.(3)160
网址:http://m.1010jiajiao.com/timu_id_57223[举报]
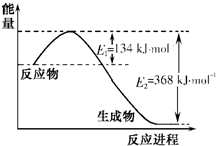 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.(2)在
①
①
中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:| t/K | 298 | 398 | 498 | … |
| K/ | 4.1×106 | K1 | K2 | … |
①写出该反应的平衡常数表达式:K=
c2(NH3)/[c(N2)×c3(H2)]
c2(NH3)/[c(N2)×c3(H2)]
②试比较K1、K2的大小,K1
>
>
K2(填写“>”“=”或“<”)③下列各项能作为判断该反应达到化学平衡状态的依据的是
C
C
(填序号字母,多选倒扣分!).A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
④400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数的值为
N2(g)+3H2(g)的化学平衡常数的值为2
2
.当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的υ(N2)(正)
>
>
υ(N2)(逆)(填写“>”、“=”或“<”).(2011?丹东模拟)[化学-选修2化学与技术]硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度
(3)选择适宜的催化剂,是否可以提高SO2的转化率?
(4)为提高SO3吸收率,实际生产中通常用
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
查看习题详情和答案>>
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是
生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等
生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等
.(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度
400℃~500℃
400℃~500℃
℃,压强0.1
0.1
MPa.| 压强/Mpa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
否
否
(填“是”或“否”),是否可以增大该反应所放出的热量?否
否
(填“是”或“否”).(4)为提高SO3吸收率,实际生产中通常用
98%的浓硫酸
98%的浓硫酸
吸收SO3.(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
B
B
(填写序号)A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
石灰水
石灰水
(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O
SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O
.(2011?宝鸡三模)[化学一选修2化学与技术]分析下面两个案例并回答有关问题.
(1)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N282%):
①利用表中数据,如何推断出SO2的催化氧化反应是一个放热反应?
②选择适应的催化剂,是否可以提高SO2的转化率?
③已知:2SO2(g)+O2(g)
2SO3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO3质量为
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.
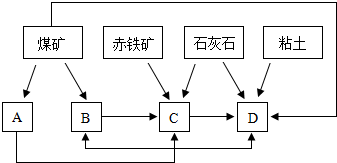
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
查看习题详情和答案>>
(1)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N282%):
|
压强/MPa SO2转化率 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
②选择适应的催化剂,是否可以提高SO2的转化率?
否
否
(填“是”或“否”)是否可以增大该反应所放出的热量?否
否
(填“是”或“否”).③已知:2SO2(g)+O2(g)
| ||
| △ |
8×103
8×103
t,由SO2生产这些SO3时放出的热量为9.85×109
9.85×109
kJ.(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.

①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
焦化厂
焦化厂
、D水泥厂
水泥厂
.②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
Fe2O3+3CO
2Fe+3CO2 、CaCO3+SiO2
CaSiO3+CO2
| ||
| ||
Fe2O3+3CO
2Fe+3CO2 、CaCO3+SiO2
CaSiO3+CO2
.
| ||
| ||
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;或用发电厂的煤矸石和粉煤灰作为水泥厂的原料;或将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;或建立污水处理系统
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;或用发电厂的煤矸石和粉煤灰作为水泥厂的原料;或将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;或建立污水处理系统
.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O
CO+3H2
(2)CO2可转化成有机物实现碳循环.将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.反应在2分钟时达到了平衡.
①用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是
②达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是
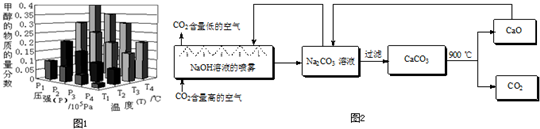
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T1>T3
D.P1>P4 T2>T3
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平
衡常数:
下列说法正确的是
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(4)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图2).
以CO2与NH3为原料可合成化肥尿素[CO(NH2)2].已知:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
H2O(l)=H2O(g)△H=+88.0kJ?mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
查看习题详情和答案>>
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
C
C
:A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| ||
(2)CO2可转化成有机物实现碳循环.将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.反应在2分钟时达到了平衡.
①用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是
3υ(CO2)正=υ(H2)逆
3υ(CO2)正=υ(H2)逆
.②达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是
CD
CD
(填序号).
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T1>T3
D.P1>P4 T2>T3
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平
衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
AC
AC
.A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(4)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图2).
以CO2与NH3为原料可合成化肥尿素[CO(NH2)2].已知:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
H2O(l)=H2O(g)△H=+88.0kJ?mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98kJ?mol-1
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98kJ?mol-1
.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知下列两个反应的热效应及平衡常数:
反应①:C(s)+H2O(g)=CO(g)+H2(g)△H1=akJ?mol-1,平衡常数为K1;
反应②:C(s)+CO2(g)=2CO(g)△H2=bkJ?mo1-1,平衡常数为K2;
又知反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc随温度的变化如下表:
回答下列问题:
(1)上述反应中,a b(填>、<或=),化学平衡常数Kc与K1、K2的关系为 .
(2)温度为800℃时,在一体积为10L的密闭容器中,通入一定量的CO和H2O (g),发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g),容器内各物质的浓度变化如下表.
800℃时物质的量浓度(mol?L-1)的变化
①表中0~2min的平均反应速率v(CO)= .
②表中第3min反应处于 状态(填“平衡”或“非平衡”);
③表中3min~4min之间,平衡向 移动(单选),可能的原因是 (单选);
表中4min~5min之间数值发生变化,可能的原因是 (单选).
a.正反应方向 b.逆反应方向 c.增加水蒸气
d.降低温度 e.使用催化剂 f.增加氢气浓度
(3)如图1、图2表示反应CO(g)+H2O(g)=CO2(g)+H2(g)在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件是 ,
②图2中时刻t2发生改变的条件是 .
查看习题详情和答案>>
反应①:C(s)+H2O(g)=CO(g)+H2(g)△H1=akJ?mol-1,平衡常数为K1;
反应②:C(s)+CO2(g)=2CO(g)△H2=bkJ?mo1-1,平衡常数为K2;
又知反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc随温度的变化如下表:
| 温度/ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
(1)上述反应中,a
(2)温度为800℃时,在一体积为10L的密闭容器中,通入一定量的CO和H2O (g),发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g),容器内各物质的浓度变化如下表.
800℃时物质的量浓度(mol?L-1)的变化
| 时间(min) | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.120 | 0.220 | 0.080 | 0.080 |
| 3 | 0.080 | 0.180 | 0.120 | 0.120 |
| 4 | 0.100 | 0.200 | 0.100 | C1 |
| 5 | 0.067 | 0.267 | 0.133 | C2 |
②表中第3min反应处于
③表中3min~4min之间,平衡向
表中4min~5min之间数值发生变化,可能的原因是
a.正反应方向 b.逆反应方向 c.增加水蒸气
d.降低温度 e.使用催化剂 f.增加氢气浓度

(3)如图1、图2表示反应CO(g)+H2O(g)=CO2(g)+H2(g)在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件是
②图2中时刻t2发生改变的条件是