摘要: C E F G H. A K.IJ20 .NaOH 实验现象离子方程式 白色沉淀Mg2*+2OH- = Mg(OH)2↓ 先产生白色沉淀.后沉淀消失Al3*+3OH-= Al(OH)3↓Al(OH)3 + OH- = AlO2 -+ 2H2O 红褐色沉淀Fe3* + 3OH- =Fe(OH)3↓
网址:http://m.1010jiajiao.com/timu_id_57217[举报]
(2009?上海一模)现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内.
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)i在b的氧化物中燃烧的方程式为
(4)h和d所形成的化合物的电子式为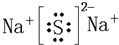
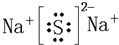 .
.
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式
 .
.
查看习题详情和答案>>
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
HF、NH3
HF、NH3
.(3)i在b的氧化物中燃烧的方程式为
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(4)h和d所形成的化合物的电子式为
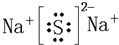
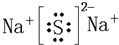
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式


下表是周期表中的一部分,根据A-K在周期表中的位置,按要求回答下列问题:
(1)上表A-K元素中,只有负价而无正价的元素是(写出元素名称,下同)
(2)比较D-、E+及K-的离子半径,由大到小的顺序为:
(3)气态氢化物最稳定的是(填物质的化学式)
(4)(本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同)
查看习题详情和答案>>
| 族周期 | ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K |
氟
氟
,金属性最强的元素是钠
钠
,原子半径最小的元素是氢
氢
.(2)比较D-、E+及K-的离子半径,由大到小的顺序为:
Cl->F->Na+
Cl->F->Na+
(3)气态氢化物最稳定的是(填物质的化学式)
HF
HF
.写出元素 C、K的气态氢化物相互反应的现象产生白烟
产生白烟
,反应化学方程式为:NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
.(4)(本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同)
NaOH
NaOH
,酸性最强的是HClO4
HClO4
,呈两性的是Al(OH)3
Al(OH)3
. 下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
(2)A、B、C、E的氢化物稳定性顺序是
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是
(4)请写出B的单质的一种重要用途
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气.请在如图方框内绘出该实验方案原理装置示意图.
I.在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故.已知过氧化铬的结构简式为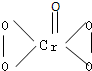 ?
?
(1)CrO5中氧元素的化合价为
(2)上述反应的离子方程式为
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i元素名称是
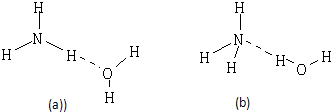
(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(3)用电子式表示e的过氧化物的形成过程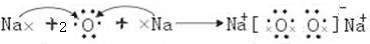
 .
.
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
查看习题详情和答案>>
 ?
?(1)CrO5中氧元素的化合价为
一个O为-2价、4个O为-1价
一个O为-2价、4个O为-1价
.(2)上述反应的离子方程式为
Cr2O72-+4H2O2+2H+=2CrO5+5H2O
Cr2O72-+4H2O2+2H+=2CrO5+5H2O
.Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | j | ||||||||||||||||
锡
锡
.(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(b)
(b)
.(填序号)
(3)用电子式表示e的过氧化物的形成过程
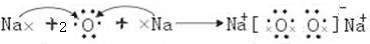
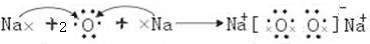
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
XeO3+3NaBrO3=3NaBrO4+Xe
XeO3+3NaBrO3=3NaBrO4+Xe
.下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)写出上表中元素D形成单质的电子式为
 ;
;
(2)元素K基态原子的电子排布式
 ;元素D原子核外的电子占有的轨道数目为
;元素D原子核外的电子占有的轨道数目为
(3)元素M位于周期表的第
(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
(6)A、C、D 形成的ACD分子中,含有
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:

查看习题详情和答案>>
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |
(1)写出上表中元素D形成单质的电子式为


(2)元素K基态原子的电子排布式
[Ar]3d54s1
[Ar]3d54s1
;H元素的离子结构示意图

5
5
个.(3)元素M位于周期表的第
ⅤⅢ
ⅤⅢ
族;当将M单质与酸性KMnO4溶液作用时,1个M原子失去3个电子,这些电子分别是在4s、3d
4s、3d
轨道上的;(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
Mg>Al>Na
Mg>Al>Na
(填对应的元素符号);三种元素最高价氧化物对应水化物的碱性由强到弱排列NaOH>Mg(OH)2>Al(OH)3
NaOH>Mg(OH)2>Al(OH)3
(填对应的化学式).(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
NH4Cl
NH4Cl
,其形成的晶体中含有的化学键类型为离子键和共价键、配位键
离子键和共价键、配位键
.(写出化学键最具体的类别)(6)A、C、D 形成的ACD分子中,含有
2
2
个σ键,2
2
个π键.(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
Mg2+<Na+<F-<O2-
Mg2+<Na+<F-<O2-
(填对应的离子符号)(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
Na2BeO2
Na2BeO2
.(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:
2:3
2:3
.两种晶胞中实际含有原子个数之比为1:2
1:2
.